
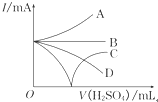
 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:分析 (1)Ba(OH)2溶液中逐滴加入稀H2SO4生成BaSO4沉淀和水;
(2)A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,混合溶液呈碱性,溶液中溶质为NaOH;
B.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,二者以1:1反应,二者反应生成硫酸钡、水和NaOH;
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,溶液中溶质为硫酸钠;
D.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至过量,混合溶液呈酸性;
(3)二者反应生成硫酸钡和水,硫酸钡难溶于水,水是弱电解质,所以随着反应进行,离子浓度减小,溶液导电能力减小,当二者恰好完全反应时溶液导电能力最小,继续加入稀硫酸,溶液中离子浓度增大,溶液导电能力增大;
(4)硫酸溶液与氢氧化钡溶液发生反应:Ba(OH)2+H2SO4═BaSO4↓+2H2O,生成沉淀BaSO4的质量等于原硫酸溶液的质量,假设硫酸钡的质量为233g,根据方程式计算的H2SO4质量,根据密度、硫酸质量计算硫酸体积,进而计算硫酸溶液中硫酸物质的量浓度.
解答 解:(1)Ba(OH)2溶液中逐滴加入稀H2SO4生成BaSO4沉淀和水,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(2)(1)中二者以1:1反应,反应后溶液呈中性,
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,混合溶液呈碱性,溶液中溶质为NaOH,不符合;
B.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,二者以1:1反应,二者反应生成硫酸钡、水和NaOH,溶液呈碱性,不符合;
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,溶液中溶质为硫酸钠,符合条件;
D.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至过量,混合溶液呈酸性,不符合,
故选C;
(3)二者反应生成硫酸钡和水,硫酸钡难溶于水,水是弱电解质,所以随着反应进行,离子浓度减小,溶液导电能力减小,当二者恰好完全反应时溶液导电能力最小,继续加入稀硫酸,溶液中离子浓度增大,溶液导电能力增大,所以曲线是C,故选C;
(4)假设硫酸钡的质量为233g,由Ba(OH)2+H2SO4═BaSO4↓+2H2O,可知H2SO4质量为98g,生成沉淀BaSO4的质量等于原硫酸溶液的质量,故原硫酸溶液的质量为233g,硫酸体积=$\frac{233g}{1.165g/mL}$=200mL=0.2L,
n(H2SO4)=$\frac{98g}{98g/mol}$=1mol,所以c(H2SO4)=$\frac{1mol}{0.2L}$=5mol/L,
故答案为:5.
点评 本题考查酸碱混合溶液定性判断、化学方程式计算、溶液导电能力大小判断等知识点,明确反应实质是解本题关键,注意:溶液导电能力与离子浓度成正比,与电解质强弱无关,难点是(4)题计算.


科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电离是指在电流作用下离解成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物都是酸 | |
| C. | 硫酸钡难溶于水,所以硫酸钡属于弱电解质 | |
| D. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用浓硫酸配制一定物质的量浓度的硫酸溶液时,溶解后的溶液未冷却至室温就转移入容量瓶,会造成所配溶液浓度偏高 | |
| C. | 溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,变浑浊,原溶液一定含有CO32- | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
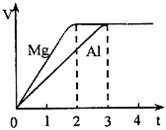 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )| A. | 反应消耗镁、铝的物质的量之比是3:2 | |
| B. | 反应消耗镁、铝的质量之比是3:2 | |
| C. | 与镁和铝反应的硫酸的物质的量之比是3:2 | |
| D. | 与镁和铝反应的硫酸的质量之比是3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | Na2SO4、酒精 | ||
| C. | 铜、二氧化硫 | D. | 熔融的KNO3、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量的发展发段为:柴草时期→化石能源时期→多能源结构时期 | |
| B. | 化石燃料种类:煤、石油、天然气,特点:蕴藏量有限,且不能再生 | |
| C. | 新能源特点:资源丰富,可以再生,没有污染 | |
| D. | 我国目前使用的主要能源是:化石燃料,它们的蕴藏量有限,而且不能再生,最终将会枯竭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com