
10分)下图是一个化学过程的示意图

回答下列问题:
(1)甲池是 装置,电极A的名称是 。
(2)甲装置中通入CH4的电极反应式为 ,
乙装置中B(Ag)的电极反应式为 ,
丙装置中D极的产物是 (写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体,若要使丙池恢复电解前的状态,
应向丙池中 (写化学式)。
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源:2014-2015河北枣强中学高二上学期期末考试化学试卷(解析版) 题型:选择题
室温下,某溶液中由水电离出来的c(OH-)=10-12mol·L-1,则该溶液的溶质不可能是
A.HCl B.NaOH C.NH4NO3 D.H2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:填空题
(7分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是_____________________。
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________mol。
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96 L,则被还原的硝酸的物质的量是_______mol,参加反应的硝酸的物质的量是______mol,产生的混合气体中NO和NO2体积比为_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
将等体积的NO2和N2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积约为原总体积的
A.1/2 B.2/3 C.1/3 D.1/6
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
下表是安徽盐业总公司专营的海藻加碘盐包装袋上的部分文字说明:
配料 | 精制盐、碘酸钾(以I计,18—33mg/kg) |
食用方法 | 烹饪时加入,菜熟后最佳 |
保存方法 | 密封避光,常温防潮 |
根据包装袋上的文字说明某学生作出如下判断,其中不正确的是
A.此食盐是混合物
B.“烹饪时加入,菜熟后最佳”的原因可能是碘酸钾受热不稳定
C.碘酸钾(KIO3)中碘的化合价+5
D.1kg此食盐中含碘酸钾(18—33)mg
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是
A.放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2
B.放电时,正极区溶液的pH减小
C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
如图所示是298 K时N2与H2反应过程中 ,能量变化的曲线图.下列叙述正确的是
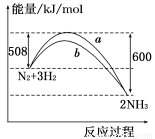
A.该反应的热化学方程式为: N2+3H2 2NH3 ΔH=-92 kJ/mol
2NH3 ΔH=-92 kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:填空题
(14分)燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是_______________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为__________,0~15min NO的平均速率v(NO)=__________mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积 b.增加CO的量
c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将______移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是_______(保留两位有效数字)。
(4)汽车尾气中的SO2和过氧化氢可设计成酸性原电池,请写出它的正极反应的方程式__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:选择题
化学与科技、社会、生产、生活密切相关。下列有关说法正确的是
A.氟利昂和NOX都能破坏臭氧层,从而导致“温室效应”
B.针对H 7 N 9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学核心
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.肌红蛋白、蚕丝、过氧化氢酶、鱼油充分水解后不能全部都得到氨基酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com