
【题目】已知某物质X能发生如图转化(四种物质均含元素R),回答下列问题:

I.已知常温下Z为一种淡黄色固体,A的水溶液能与铝反应产生氢气,则:
(1)单质X的化学式为_________,工业上Z可以用于____________。(任写一种用途)
(2)A的水溶液与铝反应的离子方程式为_______________________________。
II.若X为一种常见金属单质,白色物质A在空气中易转化为红褐色。则:
(1)Z加入酸性KMnO4溶液中,溶液由紫色褪至无色,说明Z具有________性(填“氧化”、“还原”或“漂白”)。
(2)实验室制备A常会变质,检验其可能变质的方法是将其溶于足量的稀硫酸,然后加入试剂___________,为了较长时间观察A的颜色,可采取的措施有____________。(任写一种)
【答案】Na 做漂白剂、杀菌剂、消毒剂、去臭剂、氧化剂等 2Al+2OH-+2H2O=2AlO2-+3H2↑ 还原 KSCN 加入苯或汽油以隔绝空气
【解析】
I.(1)Z为一种淡黄色固体,A的水溶液能与铝反应产生氢气,说明A为NaOH,那么Z为Na2O2,进一步可知X为Na,由此分析作答;
(2)氢氧化钠水溶液与金属铝反应生成偏铝酸钠和氢气;
II.(1)白色物质A在空气中易转化为红褐色,可知A为Fe(OH)2,进一步可知X为Fe,Z加入酸性KMnO4溶液中,溶液由紫色褪至无色,说明发生了氧化还原反应;
(2)Fe(OH)2易被氧化为Fe(OH)3,若A变质,加入硫酸后形成Fe3+,利用KSCN进行检验;欲较长时间观察白色沉淀,需隔绝空气。
I.(1)由分析可知X为Na,Z为Na2O2,工业上过氧化钠在工业上常用做漂白剂、杀菌剂、消毒剂、去臭剂、氧化剂等;
(2)氢氧化钠水溶液与金属铝反应生成偏铝酸钠和氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
II.(1)白色物质A在空气中易转化为红褐色,可知A为Fe(OH)2,进一步可知X为Fe,Z加入酸性KMnO4溶液中,溶液由紫色褪至无色,说明发生了氧化还原反应,且高锰酸钾作氧化剂体现氧化性,因此Z作还原剂,体现还原性;
(2)Fe(OH)2易被氧化为Fe(OH)3,若A变质,加入硫酸后形成Fe3+,加入KSCN后溶液变为血红色,可用于检验A是否变质;A易变质,欲较长时间观察白色沉淀,可隔绝空气,在体系中加入苯或汽油以隔绝空气。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】将10.8g表面被氧化的金属钠投入到足量的水中得到溶液200mL,并生成2.24L的气体(标准状况下)。往得到的溶液中通入一定量的CO2气体,充分反应后将溶液低温蒸干,得到固体27.4g。求:
(1)原金属中单质钠的质量分数(保留一位小数)___;
(2)所得200mL溶液的物质的量浓度___;
(3)通入的CO2在标准状况下的体积___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室研究某些气体的性质可用如图所示装置,下列过程和结论均正确的是

项选 | X | Y | Z | 结论 |
A | Br2 | 苯 | NaOH 溶液 | 苯与溴发生取代反应 |
B | SO2 | 酸性KMnO4溶液 | NaOH 溶液 | 二氧化硫具有漂白性 |
C | HCl | Na2SiO3溶液 | NaCl 溶液 | Cl 的非金属性强于Si |
D | CH2= CH2 | Br2 的CCl4溶液 | AgNO3溶液 | 乙烯与Br2发生加成反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)COCl2的空间构型为______________,溴的基态原子价电子排布式为_____________。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____________(填字母)式发生。
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____。
元素 | 氟 | 氯 | 溴 | 碘 |
第一电离能/ (kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是__________(填字母)。
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为______________,写出一个与CN—互为等电子体的物质的分子式:______________。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为__________。已知该氧化物的密度是ρg·cm-3,则晶胞内离得最近的两个钙离子的间距为_________cm(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.在火柴头浸取的水溶液中滴入AgNO3溶液,稀硝酸溶液检验氯元素时离子反应:Ag++Cl-=AgCl↓
B.NaNO2溶液中滴加适量稀盐酸:2![]() +2H+=H2O+NO↑+NO2↑
+2H+=H2O+NO↑+NO2↑
C.向Cu(NO3)2溶液中加入过量氨水:Cu2++2NH3H2O= Cu(OH)2↓+2![]()
D.苯酚与三氯化铁溶液反应,得到溶液显紫色:6C6H5O-+Fe3+=[Fe(OC6H5)6]3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下自然界存在如下反应:14CuSO4+5FeS2+l2H2O=7Cu2S+5FeSO4+12H2SO4,下列说法中不正确的是
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有21mole—转移
C.CuSO4和FeS2是氧化剂,FeS2是还原剂
D.产物中的SO42—有一部分是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连化物所CO2催化转化为CO的研究获得新成果。下图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法正确的是
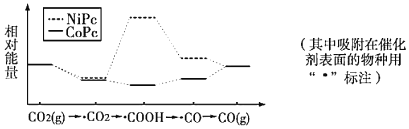
A.CO2(g)→CO(g)+l/2O2(g)过程中能量降低
B.CO2经氧化反应得到COOH
C.该条件下,催化剂NiPc比CoPc对CO2(g)→CO(g)转化效率更高
D.该研究成果将有利于缓解温室效应并解决能源转化问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题:
A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)以下分别是哪种元素(用元素符号填空):
A:_____________;C:_____________;D:____________;
(2)B原子的核外电子排布式_____________;写出A的负一价阴离子的电子式_____________。
(3)E的原子结构示意图_____________。
(4)写出由A、C两元素形成的18e-分子的形成过程:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
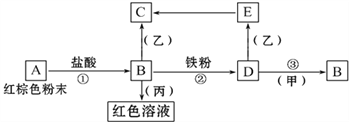
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com