
分析 A、E为短周期元素中的某单质,B、C为其化合物,能连续与E反应,E为O2,则B、C应为氧化物,短周期元素形成的氧化物中,常见氧化物有CO2、SO3或NO2,、Na2O2,BC为氯化物,则E为Cl2,如P有神形成三氯化磷、五氯化磷,以此推断可解答该题.
解答 解:A、E为短周期元素中的某单质,B、C为其化合物,能连续与E反应,E为O2,则B、C应为氧化物,短周期元素形成的氧化物中,常见氧化物有CO2、SO3或NO2,、Na2O2,BC为氯化物,则E为Cl2,如P有神形成三氯化磷、五氯化磷等,
(1)符合转化关系的可以是碳单质,C$\stackrel{O_{2}}{→}$CO$\stackrel{O_{2}}{→}$CO2,故答案为:C,CO,CO2;
(2)符合转化关系的可以是硫单质,S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3,故答案为:S,SO2,SO3;
(3)符合转化关系的可以是氮气单质,N2$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2,故答案为;N2,NO,NO2;
(4)符合转化关系的可以是金属钠,Na$\stackrel{O_{2}}{→}$Na2O$\stackrel{O_{2}}{→}$Na2O2,故答案为:Na,Na2O,Na2O2;
点评 本题考查无机物的推断,题目难度不大,本题注意短周期元素形成的氧化物中能与水反应的物质,此为解答该题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 可简写为
可简写为 .现有某化合物w的分子结构可表示为
.现有某化合物w的分子结构可表示为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
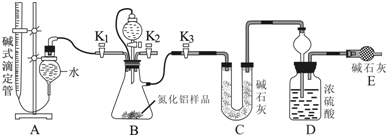
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 油脂是人体需要的重要的营养成分,属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
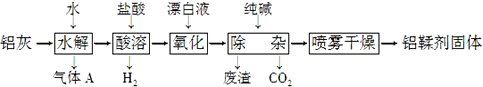
| A. | 气体A能使湿润的红色石蕊试纸变蓝 | |
| B. | “水解”采用90℃而不在室温下进行的原因是加快AlN的水解和使氨气溢出 | |
| C. | “废渣”成分为Al(OH)3和Fe(OH)3 | |
| D. | 采用喷雾干燥而不用蒸发的原因是防止Al(OH)2Cl水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的溶液中:Na+、ClO-、SO42-、I- | |
| B. | 由水电离的c(H+)=l×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | 既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、CO32-、SO32-、NO3 | |
| D. | 无色透明的溶液中:K+、Cu2+、SO42-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com