
| A. | ①⑤⑦ | B. | ④⑥⑦ | C. | ②③⑤ | D. | ③④⑥ |
分析 ①高温才能使蛋白质变性;
②常温下浓硝酸与铝发生钝化;
③制造光缆的主要材料是单质二氧化硅;
④结构陶瓷碳化硼(B4C3)常用于制造切削工具,硬度高,它属于原子晶体;
⑤金刚石与氧气发生反应生成CO2;
⑥玻璃、水泥的生产中都要用石灰石做原料;
⑦Na2O2可与CO2、H2O反应生成O2.
解答 解:①病毒的成分是蛋白质,高温才能使蛋白质变性,故①错误;
②常温下浓硝酸与铝发生钝化,故②错误;
③制造光缆的主要材料是单质二氧化硅,故③错误;
④结构陶瓷碳化硼(B4C3)常用于制造切削工具,硬度高,它属于原子晶体,是一种新型无机非金属材料,故④正确;
⑤金刚石与氧气发生反应,生成CO2,故⑤错误;
⑥玻璃、水泥的生产中都要用石灰石做原料,故⑥正确;
⑦Na2O2可与CO2、H2O反应生成O2,用于呼吸面具中作为氧气的来源,故⑦正确.
故选B.
点评 本题考查蛋白质的变性、铝的钝化、结构陶、玻璃的生产原料、过氧化钠的性质等,难度不大,注意一些记忆性知识.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
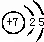 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物YR4中各原子均满足8电子稳定结构 | |
| B. | 对应原子半径:Z<W<R | |
| C. | W与X、W与Y形成的化合物化学键类型完全相同 | |
| D. | Y的最高价氧化物对应的水化物是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,离子半径越小 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Q1+0.5Q2 | B. | 4Q1+Q2+10Q3 | C. | 4Q1+2Q2 | D. | 4Q1+0.5Q2+9Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | ||
| Y | Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com