
分析 CH3COO-+H+?CH3COOH现要使平衡向右移动且氢离子浓度增大,应是增大氢离子浓度;已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂.所以碳酸钠和生成的醋酸钠不能写成离子,醋酸完全电离,据此书写离子方程式.
解答 解:已知CH3COO-+H+?CH3COOH现要使平衡向右移动且氢离子浓度增大,
A.加入氢氧化钠和氢离子反应平衡左移,氢离子浓度减小,故A错误;
B.加入盐酸,氢离子浓度增大,平衡在进行,故B正确,
C.加入水平衡逆向进行,氢离子浓度减小,故C错误;
D.升高温度,平衡向逆向进行,故D错误;
故选B.
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂.所以碳酸钠和生成的醋酸钠不能写成离子,醋酸完全电离,据此书写离子方程式:Na2CO3+2H++2CH3COO-=2CH3COONa+H2O+CO2↑,
故答案为:B; Na2CO3+2H++2CH3COO-=2CH3COONa+H2O+CO2↑.
点评 本题考查了弱电解质电离平衡影响因素分析、物质在不同溶剂中的存在形式不同,离子方程式书写需要依据条件来书写,题目难度中等.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 将稀硫酸改用浓硫酸 | B. | 向稀硫酸中加入少量硫酸铜溶液 | ||
| C. | 向稀硫酸中加入硫酸钠固体 | D. | 给装置中发生反应的部分加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
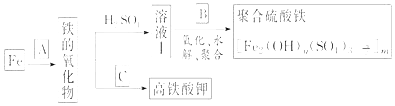
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4含有4NA个Cl原子 | |
| B. | 16gO2和O3组成的混合气体中含有的原子数为NA | |
| C. | 1 mol Na2O2与足量H2O完全反应,转移电子数为2 NA | |
| D. | 78g Na2O2所含的阴离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是制造光导纤维的材料 | B. | Fe3O4常用于红色油漆和涂料 | ||
| C. | Na2SiO3常用作制木材防火剂 | D. | NaHCO3常用作面粉发泡剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
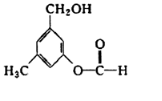 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 酸 | H2CO3 | CH3COOH | HClO |
| K | K1=4.4×10-7;K 2=4.7×10-11 | K=1.76×10-5 | K=2.95×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com