
��֪A��B��C��D֮���ת����ϵA + B �� C + D������˵������ȷ���ǣ� ��
A����AΪFe��DΪ��������B�������ᣬҲ������ˮ
B����A��DΪ�����BΪˮ����C���������嵥�ʣ�Ҳ�����ǻ�����
C����A��B��C��D��Ϊ������÷�Ӧһ�����ڸ��ֽⷴӦ
D����A��B��C��D��Ϊ10����������C�ǿ�ʹʪ��ĺ�ɫʯ����ֽ���������壬��D
������һ����Һ̬
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л�����ķ����У�����ԭ�Ӷ�����ͬһƽ�����
A�����顡�������������� B���ױ�
C�����ұ� D��������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ijԪ�صĵ���0.1mol��Cl2��ַ�Ӧ���������������ԭ���ʵ�����������7.1g ������Ԫ�ؿ����ǣ� ��
A��Mg B��Fe C��Na D��Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���п�״�����ڳ���ʱ��ȫ����������ŨHNO3���ǣ� ��
A��Au�������� B��Cu ����������C��A1 ��������D��Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ָ����������Һ�У��ܴ��������һ�������ǣ� ��
A��pH=1����Һ�У�NH4+��Fe2+��SO42����ClO��
B��ͨ�����SO2��������Һ�У�K+��Na+��CO32����SO42��
C��AlO2һ ��Ũ��Ϊ0.1 mol/L����Һ�У�K+��Na+��SiO32����SO42��
D�������£���ˮ�������c(H+)=1��10��11 mol/L����Һ�У�Fe3+��Br����Cl����SCN��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��22.4g��Fe2O3��Cu�Ļ�����м���0.5mol/L��������Һ600mLʱ������ǡ����ȫ�ܽ⣬������Һ�в���Fe3+�����ù�����CO�ڸ����»�ԭ��ͬ������ԭ����������ٵ�����Ϊ
A��6.4g ������ �� B��4.8g���������� C��2.4g ���� ���� D��1.6g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ�������������е�5�֣�������ˮ�ĵ��뼰���ӵ�ˮ�⣩�Ҹ����������ʵ�����Ϊ1 mol ��
�����ӣ�Na+ ��Mg2+ ��Fe3+ ��Al3+ ��Fe2+ �������ӣ�OH����CO32����Cl����NO3����SO42����
��������Һ�м���KSCN��Һ�����Ա仯��
������ԭ��Һ�м���ϡ���ᣬ����ɫ�������ɣ���Һ������������䣻 ���ƶϣ�
��1��ԭ��Һ�к��������� ����������
��2����ԭ��Һ�м�������ϡ���ᷢ����Ӧ�����ӷ���ʽ
��3������ԭ��Һ�м���������NaOH��Һ����ַ�Ӧ����ˣ�ϴ�ӣ����������أ��õ��Ĺ���
����Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���н�����ʵ�ķ���ʽ����ȷ���ǣ� ��
A����0.1 mol/L�İ�ˮ��pHΪ11�� NH3��H2O  NH4+ +OH��
NH4+ +OH��
B����Na�����ˮ�У��������壺2Na+2H2O= 2OH��+2Na++H2��
C��AlƬ����NaOH��Һ�У��������壺2Al+2OH��+2H2O = 2AlO2�� +3H2��
D����CuCl2��Һ��������ʵ�飬���ݷ��⣺CuCl2  Cu2+ +2 Cl��
Cu2+ +2 Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ�IJ����У��е���ͬ���칹�壬�е�û��ͬ���칹�壬����һ��������ͬ���칹��ķ�Ӧ��
A�������ϩ( )������ʵ�����Br2�����ӳɷ�Ӧ
)������ʵ�����Br2�����ӳɷ�Ӧ
B��2�ȶ���(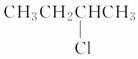 )��NaOH���Ҵ���Һ���ȷ�����ȥHCl���ӵķ�Ӧ
)��NaOH���Ҵ���Һ���ȷ�����ȥHCl���ӵķ�Ӧ
C���ױ���һ�������·�������������һ�����ױ��ķ�Ӧ
D�����ǻ���������NaHCO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com