
25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO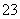 )均增大
)均增大
科目:高中化学 来源: 题型:
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是
CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是
| A.该反应的正反应的△H>0 |
| B.反应进行到5min时,a容器中v正=v逆 |
| C.减压可将b中的平衡状态转变成c中的平衡状态 |
| D.达到平衡时,a、b、c中CO的转化率为b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B两种常见化合物组成的混合物,其焰色反应均为黄色,其相互转化关系如图(其他物质均略去)。
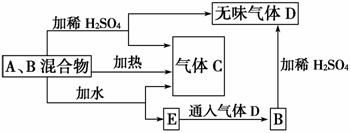
根据以上关系,回答下列问题:
(1)写出A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出混合物中加水反应的化学方程式:______________________________________。
(3)加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为________(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
医疗上的血液透析原理同胶体的渗析类似。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。血液中,蛋白质和血细胞不能通过透析膜,血液中的毒性物质可以透过,由此可以判断( )
A.蛋白质、血细胞的粒子直径大于毒性物质的直径
B.蛋白质以分子形式存在,毒性物质以离子形式存在
C.蛋白质、血细胞不溶于水,毒性物质可溶于水
D.蛋白质、血细胞不能透过滤纸,毒性物质可以透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
有关①100 mL 0.1 mol/L NaHCO3、②100 mL 0.1 mol/L Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO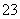 )>c(H2CO3)
)>c(H2CO3)
D.②溶液中:c(HCO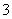 )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中操作、现象、结论对应关系正确的一组是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 在蔗糖中加入几滴水搅拌均匀,再加入浓硫酸,迅速搅拌 | 蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质 | 只体现了浓硫酸的脱水性 |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 溴乙烷和氢氧化钠溶液充分反应后,用足量稀硝酸酸化,再加入硝酸银溶液 | 生成淡黄色沉淀 | 溴乙烷中含有溴元素 |
| D | 将溴水加入苯中并充分振荡 | 溴水褪色 | 苯与溴发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,AgBr的Ksp=4.9×10-13、AgI的Ksp=8.3×10-17。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同);
②若改加更多的AgI,则c(Ag+)________;
③若改加AgBr固体,则c(I-)____________________;而c(Ag+)________。
(2)有关难溶盐的溶度积及溶解度(与AgBr、AgI无关),有以下叙述,其中正确的是________。
A.两种难溶盐电解质,其中Ksp小的溶解度一定小
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶 电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀
E.难溶盐电解质的Ksp和温度有关
F.加入与原难溶电解质具有相同离子的物质,使难溶电解质的溶解度变小,也使Ksp变小
(3)现向含有NaBr、KI均为0.002 mol/L的溶液中加入等体积的浓度为4×10-3 mol/L AgNO3溶液,则产生的沉淀是________(填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应式表示为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com