
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 
根据判断出的元素回答问题:
(1)y在元素周期表中的位置是 . z、d、e、f四种元素的简单离子中,半径最大的是(填离子符号)
(2)e的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程 式
(3)z的氢化物和h的氢化物反应形成化合物A,A中含有的化学键类型为;
(4)含f的某化合物可用作净水剂的原理是(用离子方程式表示)
(5)25℃,f的最高价氧化物的水化物的Ksp=1.0×10﹣34 , 使含0.1molL﹣1 f离子的溶液开始产生沉淀的pH为 .
(6)元素e和g组成的化合物B的水溶液中离子浓度由大到小的顺序为 .
【答案】
(1)第二周期IVA族;N3﹣
(2)2Cl﹣+2H2O ![]() 2OH﹣+Cl2↑+H2↑
2OH﹣+Cl2↑+H2↑
(3)离子键、共价键
(4)Al3++3H2O=Al(OH)3(胶体)+3H+
(5)3
(6)c(Na+)>c(S2﹣)>c(OH﹣)>c(HS﹣)>c(H+)
【解析】解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1.)y为碳元素,处于周期表中第二周期IVA族,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(N3﹣)>r(O2﹣)>r(Na+)>r(Al3+);所以答案是:第二周期IVA族;N3﹣;
(2.)工业上电解饱和氯化钠溶液生成氢氧化钠,离子方程式为:2Cl﹣+2H2O ![]() 2OH﹣+Cl2↑+H2↑,所以答案是:2Cl﹣+2H2O
2OH﹣+Cl2↑+H2↑,所以答案是:2Cl﹣+2H2O ![]() 2OH﹣+Cl2↑+H2↑;
2OH﹣+Cl2↑+H2↑;
(3.)z的氢化物和h的氢化物反应形成化合物A为NH4Cl,含有离子键、共价键,所以答案是:离子键、共价键;
(4.)铝盐溶液中铝离子水解:Al3++3H2O=Al(OH)3(胶体)+3H+ , 生成氢氧化铝胶体,可以用于净水,所以答案是:Al3++3H2O=Al(OH)3(胶体)+3H+;
(5.)Al3+沉淀时c(OH﹣)= ![]() mol/L=10﹣11mol/L,则c(H+)=
mol/L=10﹣11mol/L,则c(H+)= ![]() mol/L=10﹣3mol/L,此时溶液pH=﹣lgc(H+)=3,所以答案是:3;
mol/L=10﹣3mol/L,此时溶液pH=﹣lgc(H+)=3,所以答案是:3;
(6.)元素e和g组成的化合物B为Na2S,溶液中硫离子水解,溶液呈碱性,溶液中氢氧根离子源于硫离子水解、硫氢根水解、水的电离,溶液中离子浓度大小为:c(Na+)>c(S2﹣)>c(OH﹣)>c(HS﹣)>c(H+),所以答案是:c(Na+)>c(S2﹣)>c(OH﹣)>c(HS﹣)>c(H+).


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A.钠钾合金和镁铝合金都是密度小、硬度大的合金
B.玉米制乙醇、蛋白质变性和纳米银粒子的聚集都是化学变化
C.石油化工的裂解气可以作为溴水提取溴单质的萃取剂
D.中国古代采用加热胆矾或者绿矾的方法制取硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H =-55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)xC(g)+2D(g),2min末反应达到化学平衡,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于;
(2)A的转化率为;
(3)生成D的反应速率为;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数将会(填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述一定正确的是( ) 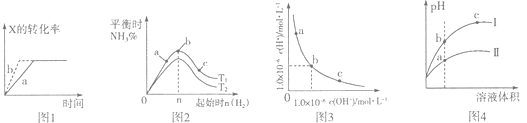
A.图l所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大
B.图2表示合成氨反应,温度T1和T2对应的平衡常数为K1、K2 , 则:T1<T2 , K1>K2
C.图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 氯化镁溶液与氨水反应:Mg2++2OH-===Mg(OH)2↓
D. 氧化铝溶于NaOH溶液:Al2O3+2OH-===2AlO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质循环过程中,不能经过一步反应实现的是 ( )
A.HCl—CuCl2B.Na2SO4一NaCl
C.CO—CO2D.Fe2O3—Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol.下列说法或表达正确的是( )
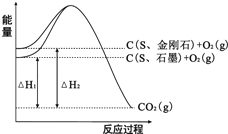
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石) △H=+1.5kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍.
(1)求该有机物的分子式 .
(2)该有机物链状同分异构体的结构简式为(有几种就写几种,不一定填满):、、、
(3)若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com