
甲酸甲酯水解反应方程式为:HCOOCH3
+ H2O  HCOOH
+ CH3OH – Q(Q>0)
HCOOH
+ CH3OH – Q(Q>0)
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表。甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
|
组分 |
物质的量/mol |
|
HCOOCH3 |
1.00 |
|
H2O |
1.99 |
|
HCOOH |
0.01 |
|
CH3OH |
0.52 |

(1)上述反应的平衡常数表达式为K=_______________________。
(2)计算15~20min范围内:甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol/min;80~90min范围内甲酸甲酯的平均反应速率为___________ mol/min。
(3)依据以上数据,推断该反应在10min后反应速率迅速加快的原因: 。
(4)其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
(1)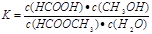 (1分)
(1分)
(2)0.045 , 9.0×10-3, 0(3分)
(3)该反应中甲酸具有催化作用,甲酸量逐渐增多,催化效果显著,反应速率明显增大。(2分)
(4)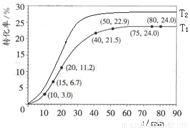 (2分)
(2分)
【解析】
试题分析:
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,平衡常数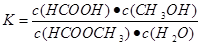 。
。
(2)根据图中的转化率可知,15min时甲酸甲酯的转化率是6.7%,则消耗甲酸甲酯的物质的量是0.067mol。20min时甲酸甲酯的转化率是11.2%,则消耗甲酸甲酯的物质的量是0.112mol,所以在15~20min内甲酸甲酯减少了0.112mol-0.067mol=0.045。则甲酸甲酯的平均反应速率为0.045mol÷5min=0.009mol/min;根据图像可知,80min后反应物的转化率不再发生变化,说明反应已经达到平衡状态,则80~90min范围内甲酸甲酯的平均反应速率为0。
(3)由于在该反应中甲酸具有催化作用,随着反应的进行,甲酸量逐渐增多,催化效果显著,反应速率明显增大。
(4)正反应是吸热反应,所以升高温度,反应物的转化率增大。且反应速率快,达到平衡的时间少,即图像是(见答案)。
考点:化学反应速率、化学平衡、化学平衡常数


科目:高中化学 来源: 题型:
 (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( ) (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( )
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省保定市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l) HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是

A.温度升高,该反应的平衡常数减小
B.0〜10min,HCOOCH3 的平均反应速率 u=0. 003mol·L-1 • min-1
C.HCOOCH3平均反应速率先是增大,后减小,最后保持不变
D.80min时,反应刚达平衡,反应物转化率保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com