
下列与化学反应能量变化相关的叙述正确的是
A.同温同压下, 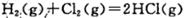 在光照和点燃条件的△H不同。 在光照和点燃条件的△H不同。 |
| B.相同条件下2mol氢原子所具有的能量小于1 mol氢分子所具有的能量 |
| C.应用盖斯定律,可以计算某些难以直接测量的反应焓变 |
D.反应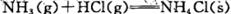 在室温下可自发进行:则该反应的△H>0 在室温下可自发进行:则该反应的△H>0 |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:单选题
氯原子对O3的分解有催化作用:O3+Cl=ClO+O2 ΔH1 ClO+O=Cl+O2ΔH2
该反应的能量变化如图示意,下列叙述中正确的是
| A.反应O3+ O=2O2的ΔH=E1-E2 |
| B.反应O3+ O=2O2的ΔH=E2-E3 |
| C.反应O3+ O= 2O2是吸热反应 |
| D.反应O3+ O=2O2的ΔH=ΔH1+ΔH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
| A.C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法或表示方法不正确的是( )
| A.盖斯定律实质上是能量守恒定律的体现 |
| B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
| C.由C(石墨)―→C(金刚石);ΔH=+73 kJ/mol,可知石墨比金刚石稳定 |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);ΔH=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某反应在反应过程中的能量变化如图所示(图中E1表示反应物总能量,E2表示生成物总能量)。下列有关叙述正确的是( )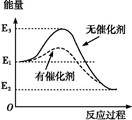
| A.该反应为吸热反应 |
| B.使用催化剂没有改变反应的反应热 |
| C.反应热等于E3-E2 |
| D.催化剂只对正反应有催化作用,对逆反应无催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室中制备乙烯的方法是使乙醇脱水,反应可以简单地表示为CH3CH2OH―→CH2=CH2↑+H2O。已知CH2=CH2(g)和C2H5OH(l)的燃烧热分别是1 411.0 kJ·mol-1和1 366.8 kJ·mol-1。则实验室用C2H5OH(l)制备CH2=CH2(g)生成1 mol液态水的ΔH为( )
| A.-44.2 kJ·mol-1 |
| B.+44.2 kJ·mol-1 |
| C.-2 777.8 kJ·mol-1 |
| D.+2 777.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂。
已知:H2(g)+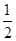 O2(g)=H2O(l)
O2(g)=H2O(l)
ΔH1=-285.8 kJ·mol-1①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1②
O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1④
下列说法正确的是( )
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热ΔH为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+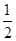 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展的经济模式。下列说法与“低碳经济”不符合的是 ( )。
| A.采用压缩天然气代替燃油 |
| B.加快化石燃料的开采与使用,提高人们的生活水平 |
| C.利用硅材料制成光伏发电装置发电 |
| D.利用太阳能、风能等,减少化石燃料的使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com