
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)CH3OH(g) ΔH<0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
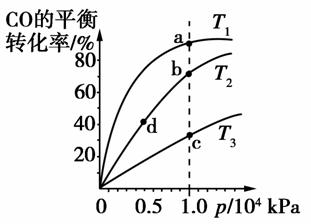
A.平衡常数:K(a)>K(c) K(b)=K(d)
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量: (a)<
(a)< (c)
(c)  (b)>
(b)> (d)
(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
解析:本题考查了化学反应速率和化学平衡知识,意在考查考生对图像的观察能力和理解能力以及对信息的挖掘能力。由图可知,a、c两点压强相等,a点CO的平衡转化率较高,而该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相等,平衡常数也相等,即K(b)=K(d),A选项正确;已推知T1<T3,温度越高,反应速率越快,故v(a)<v(c),b、d两点温度相等,压强越大,反应速率越快,b点压强大于d点,则v(b)>v(d),B选项错误;CO的平衡转化率越大,n总越小,由 =m/n总可知,n总(a)<n总(c),n总(b)<n总(d),则
=m/n总可知,n总(a)<n总(c),n总(b)<n总(d),则 (a)>
(a)> (c),
(c), (b)>
(b)> (d),C选项错误;根据题意可知平衡时a点n(CO):n(H2)不一定等于1:2,D选项错误。
(d),C选项错误;根据题意可知平衡时a点n(CO):n(H2)不一定等于1:2,D选项错误。
答案:A


科目:高中化学 来源: 题型:
下列有关元素周期表中元素性质的叙述中正确的是( )
A. 同主族元素从上到下,非金属性逐渐增强
B. 元素的最高正化合价均等于它所在的族序数
C. 同周期的主族元素的原子半径越小,越难失去电子
D. 第ⅤA族元素的氢化物的沸点,从上到下依次逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
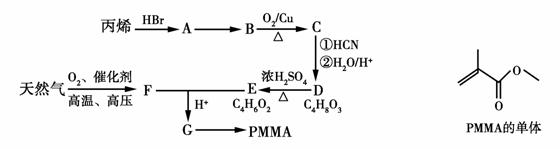
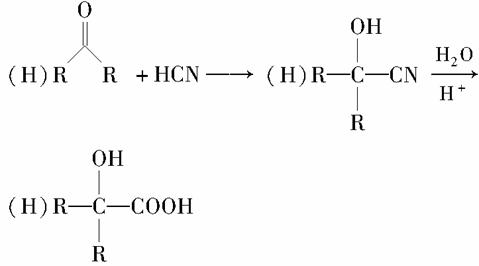
有机玻璃(PMMA)成分为聚甲基丙烯酸甲酯,因其透光性好、性能优良、价格低廉,广泛应用于商业,轻工、建筑、化工等方面,甚至人工角膜也是有机玻璃。其单体的结构和工业合成路线如图所示。
请回答下列问题:
(1)有机玻璃单体的分子式为________________。
(2)请指出反应类型:D→E属于________________反应,E+F→G属于________________反应。
(3)请指出A→B的反应条件:________________________。
(4)请写出B→C的化学方程式:______________________。
(5)写出同时符合下列条件的G的同分异构体的结构简式,请写出3种:__________________________________________________。
①能使溴水褪色;②能在碱性条件下水解;③能发生银镜反应;④具有支链。
(6)以苯乙酮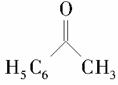 为主要原料合成
为主要原料合成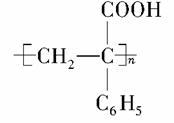 ,请设计合成路线(无机试剂任选),格式参照如下过程:CH3CHO
,请设计合成路线(无机试剂任选),格式参照如下过程:CH3CHO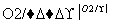 CH3COOH
CH3COOH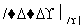 CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如下图,则下列说法正确的是( )
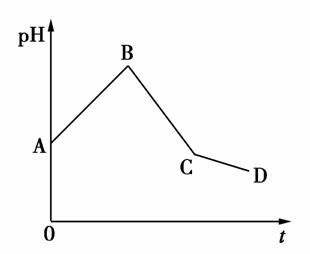
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.BC段表示在阴极上是H+放电产生了H2
C.整个过程中阳极先产生Cl2,后产生O2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示(10 min时达到第一次平衡),下列说法正确的是( ) 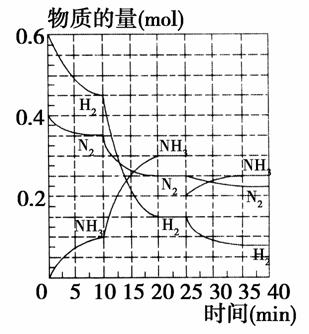
A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min)
B.从曲线可以看出,反应进行到10 min至20 min时可能是使用了催化剂
C.从曲线可以看出,反应进行至25 min时,增加了0.1 mol的氨气
D.在25 min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
在一恒容的密闭容器中充入0.1 mol/L CO2、0.1 mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )

A.上述反应的ΔH<0
B.压强:p4>p3>p2>p1
C.1100 ℃时该反应平衡常数为1.64
D.压强为p4时,在y点:v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)+H2O(g)CO(g)+H2(g),该反应的化学平衡常数表达式为K=________。
若反应的逆反应速率与时间的关系如图所示:
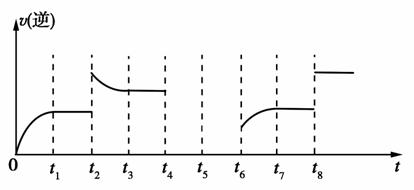
①可见反应在t1、t3、t7,时都达到了平衡,而t2、t8时都改变了一种条件,试判断t2时改变的是什么条件:t2时________________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
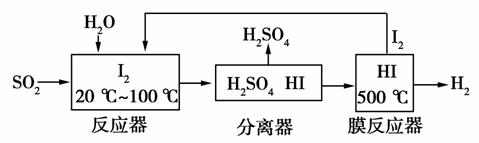
①用离子方程式表示反应器中发生的反应:________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol·L-1和2 mol·L-1,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO) ( )
A.0.448 L B.0.672 L
C.0.896 L D.0.224 L
查看答案和解析>>
科目:高中化学 来源: 题型:
在含等物质的量浓度的Fe3+、NH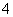 、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
、H+、Al3+溶液中,逐滴滴加氢氧化钠溶液,生成物依次产生的顺序是( )
A.Fe(OH)3、H2O、Al(OH)3、NH3·H2O、NaAlO2
B.Al(OH)3、NH3、H2O、Fe(OH)3、NaAlO2、H2O
C.H2O、Fe(OH)3、Al(OH)3、NH3·H2O、NaAlO2
D.H2O、Fe(OH)3、Al(OH)3、NaAlO2、NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com