
可用下图所示装置制取、净化、收集气体的是
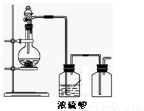
A.锌和稀硫酸反应制氢气
B.浓氨水与氧化钙固体反应制氨气
C.亚硫酸钠固体与较浓硫酸反应制二氧化硫
D.铜与稀硝酸反应制一氧化氮
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:选择题
为了改善食品色、香、味,我们在食物中加入某些食品添加剂。下列食品添加剂的使用不合理的是
A.在烹饪食物时,加入适量食盐
B.在饮料制作中,为了更美观,常加入大量的天然色素
C.在烹饪鱼类食物时,加入适量食醋
D.为了补充营养物质,食品中加入少量维生素
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
在恒容密闭容器中发生反应2NO2  2NO+O2,下列所述可以说明反应达到平衡状态的是
2NO+O2,下列所述可以说明反应达到平衡状态的是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变
A.①③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)2014年10月24日,我国探月工程三期再入返回飞行试验器在西昌卫星发射中心由长征三号丙运载火箭发射升空。火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C == K2S + N2 ↑+ 3CO2 ↑。
①写出该反应的氧化剂: ;K2S的电子式为 ;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式: ;
实验二:取黑火药爆炸反应后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊(S)后又变澄清(SO42-)。请设计实验方案证明该澄清溶液中含有Cl-: ;
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵(NH4C1O4)、铝粉复合推进剂。高氯酸铵水溶液呈酸性的原因是 ;(用离子方程式表示)
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮;可燃物有肼(N2H4)、偏二甲肼等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏二甲肼的系统命名为1,1-二甲基联氨,则它的分子式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
元素周期律和元素周期表是学习化学的重要工具,下列说法正确的是
A.门捷列夫根据原子量排列的周期表成功预言了类铝(镓)、类硅(锗)等元素的存在
B.铀(U)属于过渡元素,能跟氟形成UF6,据此可推测U原子最外层有6个电子
C.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱,沸点依次升高
D.Na、Mg、Al原子的最外层电子数依次增加,故失去电子的能力越来越强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
在水溶液中,YO3n-和S2-发生如下反应:YO3n- + 3S2- +6H+ = Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为
A.+4、6 B.+7、7 C.+5、7 D.+5、5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:填空题
[化学一选修2:化学与技术](15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:

金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①② B.②④ C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图

(1)向沉淀池中要通入CO2和氨气,应选通入______(填化学式)。原因是______________。
(2)沉淀池中发生反应的化学方程式是__________________________________。
(3)母液中的溶质主要是________。向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是_____________________________________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,物质X是__________,从沉淀池中提取沉淀的操作是__________。
(5)写出煅烧炉中发生反应的化学方程式_____________________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是____________(填化学式),为检验该杂 质的存在,具体操作是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com