
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E、F用所对应的元素符号表示)
A | A原子核外电子有6种不同的运动状态 |
B | B元素的第一电离能比同周期相邻两个元素都大 |
C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
D | D原子最外层电子数等于电子层数 |
E | E的基态原子最外层电子排布式为3s23p2 |
F | F与C位于不同周期,F原子核外最外层电子数与C相同,其余各层电子均充满 |
(1)F基态原子核外价电子排布式是________________
(2)A、B、E三种元素电负性由大到小排列顺序为__________________
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为________________

(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g) ![]() B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式__________________
(5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度______g·cm-3(不必计算出结果)。
(6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为_______________
(7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式_______________
(8)某学生所做的有关F元素的实验流程如下图:
F单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:___________________
【答案】 3d104s1 N>C>Si sp2杂化 CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1kJ/mol ![]() 30 H2O2+2e- + 2H+ = 2H2O [Cu (NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O
30 H2O2+2e- + 2H+ = 2H2O [Cu (NH3)4]2++H2S+2H2O====CuS↓+2NH4++2NH3·H2O
【解析】A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加,C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色,则C为Na;A原子核外电子有6种不同的运动状态,A为碳元素;B的原子序数介于碳、氧之间,则B为N元素;E的基态原子最外层电子排布式为3s23p2,则E为Si;D原子最外层电子数等于电子层数,原子序数介于E和C之间,则D是Al;F与C位于不同周期,F处于第四周期,F原子核外最外层电子数与C相同,其余各层电子均充满,原子核外电子数=2+8+18+1=29,则F为Cu。
(1)铜原子的基态原子核外价电子排布式是3d104s1;(2)非金属性越强,电负性越大,则A、B、E三种元素电负性由大到小排列顺序为N>C>Si;(3)根据结构可知类似于石墨的的层状结构,则N原子的杂化类型为sp2杂化。(4)已知:①、CH4(g)+2 NO2(g)= N2(g)+CO2(g)+2H2O (g) △H1=-867kJ/mol,②、2NO2(g)N2O4(g)△H2=-56.9kJ/mol,由盖斯定律,①-②得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1kJ/mol;(5)Al单质为面心立方晶体,晶胞中含有铝原子的个数是4,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,则其单质的密度为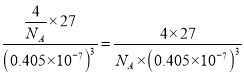 g·cm-3。(6)Si60分子中每个Si原子只跟相邻的3个原子形成共价键,且每个Si原子最外层都满足8电子稳定结构,则每个Si形成的这3个键中,必然有1个双键,这样每个Si原子最外层才满足8电子稳定结构,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30;(7)原电池中负极发生失去电子的氧化反应,则铜是负极,正极是双氧水得到电子,电极反应式为H2O2+2e- + 2H+ = 2H2O。(8)蓝色溶液是铜离子和氨水形成的络离子,铜离子具有氧化性,则第⑤步反应的离子方程式为[Cu (NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3·H2O。
g·cm-3。(6)Si60分子中每个Si原子只跟相邻的3个原子形成共价键,且每个Si原子最外层都满足8电子稳定结构,则每个Si形成的这3个键中,必然有1个双键,这样每个Si原子最外层才满足8电子稳定结构,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30;(7)原电池中负极发生失去电子的氧化反应,则铜是负极,正极是双氧水得到电子,电极反应式为H2O2+2e- + 2H+ = 2H2O。(8)蓝色溶液是铜离子和氨水形成的络离子,铜离子具有氧化性,则第⑤步反应的离子方程式为[Cu (NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3·H2O。


科目:高中化学 来源: 题型:
【题目】目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是
A.Fe B.葡萄糖 C.MgSO4 D.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是

A.H2(g)和O2(g)反应生成H2O(g),这是个吸热反应过程
B.由2mol H2和1mol O2变成4mol H、2mol O原子,这是个放热反应过程
C.2mol H2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量
D.4mol H、2mol O生成2mol H2O(g),共放出484kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(s)![]() x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. 反应达到平衡状态时A的转化率为60%
B. x=4
C. 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D. 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的主要内容之一是从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应不符合“绿色化学”理念的是
A. 制氯乙烷:CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
B. 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
C. 制CuSO4:2Cu+O2=2CuO, CuO+H2SO4(稀)=CuSO4+H2O
D. 制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氮族、氧族、卤素中NH3、H2O、HF出现沸点反常现象是由于( )
A. 分子间的结合力减小了
B. 键的极性很弱
C. 分子间产生了一种氢键的相互作用
D. 共用电子对强烈地偏向H原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:

①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3 min~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)反应中浓硫酸的作用是______________________________________;
写出制取乙酸乙酯的化学方程式:_____________________________。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是___________________;
步骤③所观察到的现象是_____________________________________;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应从仪器________(填“下口放”或“上口倒”)出。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com