【答案】
分析:(1)电解质是指:该物质是化合物,溶于水溶液中或在熔融状态下就能够导电,是自身电离.酸、碱、盐都是电解质,在水溶液中和在熔融状态下两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质,据此即可解答.
(2)类卤素与卤素单质的性质相似,所以可以用替代法来判断;
(3)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,二氧化锰、氯气、水在离子反应中应保留化学式,据此解答;
(4)氯气具有强氧化性,与KI反应生成单质碘,能使淀粉变蓝,据此解答;
(5)根据水和无色液体A的溶解性解答.
解答:解:(1)A、熔融状态的硝酸钾能导电是强电解质; B、稀硫酸能导电,但它是硫酸的溶液,所以它既不是电解质,也不是非电解质; C、醋酸(CH
3COOH)只有乙酸分子,不能导电,但在水溶液中能导电,是弱电解质; D、BaSO
4固体,没有自由移动的离子,但熔融状态下,能导电,是强电解质;E、酒精,只有乙醇分子,不能导电,在水溶液中,不能电离,只有乙醇分子,是非电解质; F、干冰只有二氧化碳分子,不能导电,在水溶液中,自身不能电离,是非电解质;G、铝,能导电,是金属单质,既不是电解质,也不是非电解质; H、食盐水,能导电,是混合物,既不是电解质,也不是非电解质; I、石墨,能导电,是非金属单质,既不是电解质,也不是非电解质;
故答案为:①A、B、G、H、I; ②A、C、D;③E、F;
(2)根据Cl
2+2NaOH=NaCl+NaOH+H
2O,(CN)
2与NaOH溶液发生的化学反应类似,可以用CN替代Cl,所以方程式为(CN)
2+2NaOH=NaCN+NaOCN+H
2O,
故答案为:(CN)
2+2NaOH=NaCN+NaOCN+H
2O;
(3)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,反应的方程式为MnO
2+4HCl(浓)
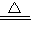
MnCl
2+Cl
2 ↑+2H
2O,二氧化锰、氯气、水在离子反应中应保留化学式其离子反应为MnO
2+4H
++2Cl
-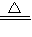
Mn
2++Cl
2↑+2H
2O,
故答案为:MnO
2+4H
++2Cl
-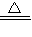
Mn
2++Cl
2↑+2H
2O;
(4)氯气具有强氧化性,与KI反应生成单质碘,能使淀粉变蓝,可将该气体通入淀粉碘化钾溶液中,溶液变蓝色证明该气体为氯气,
故答案为:将氯气通入淀粉碘化钾溶液,溶液变蓝色证明该气体为氯气;
(5)无色液体A与水互不相溶,现向试管中分别注入等体积的A液体以及蒸馏水,静止分层后,取上层液体加蒸馏水,震荡混合后,不分层,则上层为无色液体A,反之为水,
故答案为:取上层液体加蒸馏水,震荡混合后,不分层,则上层为无色液体A,反之为水.
点评:本题较为综合,考查了电解质、非电解质、导电与电解质的关系,实验室制取氯气等,内容综合性强,题目难度中等.

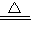 MnCl2+Cl2 ↑+2H2O,二氧化锰、氯气、水在离子反应中应保留化学式其离子反应为MnO2+4H++2Cl-
MnCl2+Cl2 ↑+2H2O,二氧化锰、氯气、水在离子反应中应保留化学式其离子反应为MnO2+4H++2Cl-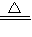 Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,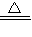 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;

 名校课堂系列答案
名校课堂系列答案