
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色的气体,易溶于水。实验室可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料来制备ClO2,其流程如下:

(1)写出电解时发生反应的化学方程式: 。
(2)除去ClO2中的NH3可选用的试剂是 。(填字母)
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。

①装置中玻璃液封管的作用是 ; 。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 。
③滴定终点的现象是: 。
④测得通入ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)(已知:ClO2的相对分子质量为67.5)
(4)设计实验来确定溶液X的成分,请补充完成实验步骤和现象。
|
实验步骤 |
实验现象 |
实验结论 |
|
① |
|
溶液X中含有Na+ |
|
② |
|
溶液X中含有Cl- |
(16分)
(1)NH4Cl+2HCl 3H2↑+NCl3(2分,配平、条件、状态不全扣1分)
3H2↑+NCl3(2分,配平、条件、状态不全扣1分)
(2)C(1分)
(3)①吸收残余的二氧化氯气体;使锥形瓶内外压强相等(各1分,共2分)
②2ClO2+10I-+8H+=4H2O+5I2+2Cl-(2分,配平错扣1分)
③最后一滴滴下时,溶液由蓝色变为无色,且半分钟内不复原(2分)
④1.35cV×10—2g(2分,单位无写扣1分)
(4)
|
实验步骤 |
实验现象 |
实验结论 |
|
①用铁丝蘸取溶液X,在酒精灯火焰上灼烧(1分) |
火焰呈黄色(1分) |
溶液X中含有Na+ |
|
②取少量溶液X,加入足量稀HNO3(1分),再滴加少量 AgNO3溶液(1分) |
出现白色沉淀(1分) |
溶液X中含有Cl- |
【解析】
试题分析:(1)观察生产流程图可得,电解步骤的反应物是NH4Cl、HCl,生成物是NCl3、H2,根据化合价升降法、原子守恒可得:NH4Cl+2HCl NCl3+3H2↑;(2)氨气易溶于水,二氧化氯也易溶于水,则饱和食盐水不仅能除去氨气,也能除去二氧化氯,故AD均错;碱石灰的主要成分是氢氧化钠和氧化钙,氨气与氢氧化钠和氧化钙均不反应,但是二氧化氯与碱石灰能反应,故B错;氨气与浓硫酸能反应,生成硫酸铵或硫酸氢铵,而二氧化氯不能与浓硫酸反应,故C正确;(3)①二氧化氯具有强氧化性,可以将KI氧化为I2,玻璃液封管可以吸收残余的二氧化氯气体、使锥形瓶内外压强相等,因为二氧化氯易溶于水,平衡锥形瓶内气压才能使二氧化氯气体顺利通入;②由于二氧化氯、氯气都能将KI氧化为I2,自身被还原为氯离子,根据化合价升降法、电荷、原子守恒原理可得,2ClO2+10I—+8H+=2Cl—+5I2+4H2O;③滴定前锥形瓶的溶液中含有I2和淀粉,淀粉遇碘单质变蓝,当最后一滴滴入时,溶液由蓝色变为无色,且半分钟内不恢复为蓝色,即达到滴定终点;④先由c•V=n求得硫代硫酸钠或硫代硫酸根离子的物质的量为c×V×10—3mol,再由I2+2S2O32-=2I-+S4O62-中I2与S2O32-的物质的量之比等于系数之比可求I2的物质的量为c×V×10—3mol×1/2,然后由2ClO2+10I—+8H+=2Cl—+5I2+4H2O中ClO2与I2的物质的量之比等于系数之比可求ClO2的物质的量为c×V×10—3mol×1/2×2/5,最后由nM=m可求二氧化氯的质量为c×V×10—3mol×1/2×2/5×67.5g/mol=1.35cV×10—2g;(4)NaClO2与NCl3、H2O发生反应,根据化合价升降法、原子守恒配平可得,6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+X,根据钠、氯、氢原子个数守恒可得X为3NaCl、3NaOH;检验X溶液含有钠离子时,用铁丝蘸取溶液X,在酒精灯火焰上灼烧,火焰呈黄色;检验X溶液含有氯离子时,必须先排除氢氧根离子对氯离子检验的干扰,即取少量溶液X,加入足量稀HNO3,再滴加少量AgNO3溶液,出现白色沉淀,说明X溶液中含有Cl-。
NCl3+3H2↑;(2)氨气易溶于水,二氧化氯也易溶于水,则饱和食盐水不仅能除去氨气,也能除去二氧化氯,故AD均错;碱石灰的主要成分是氢氧化钠和氧化钙,氨气与氢氧化钠和氧化钙均不反应,但是二氧化氯与碱石灰能反应,故B错;氨气与浓硫酸能反应,生成硫酸铵或硫酸氢铵,而二氧化氯不能与浓硫酸反应,故C正确;(3)①二氧化氯具有强氧化性,可以将KI氧化为I2,玻璃液封管可以吸收残余的二氧化氯气体、使锥形瓶内外压强相等,因为二氧化氯易溶于水,平衡锥形瓶内气压才能使二氧化氯气体顺利通入;②由于二氧化氯、氯气都能将KI氧化为I2,自身被还原为氯离子,根据化合价升降法、电荷、原子守恒原理可得,2ClO2+10I—+8H+=2Cl—+5I2+4H2O;③滴定前锥形瓶的溶液中含有I2和淀粉,淀粉遇碘单质变蓝,当最后一滴滴入时,溶液由蓝色变为无色,且半分钟内不恢复为蓝色,即达到滴定终点;④先由c•V=n求得硫代硫酸钠或硫代硫酸根离子的物质的量为c×V×10—3mol,再由I2+2S2O32-=2I-+S4O62-中I2与S2O32-的物质的量之比等于系数之比可求I2的物质的量为c×V×10—3mol×1/2,然后由2ClO2+10I—+8H+=2Cl—+5I2+4H2O中ClO2与I2的物质的量之比等于系数之比可求ClO2的物质的量为c×V×10—3mol×1/2×2/5,最后由nM=m可求二氧化氯的质量为c×V×10—3mol×1/2×2/5×67.5g/mol=1.35cV×10—2g;(4)NaClO2与NCl3、H2O发生反应,根据化合价升降法、原子守恒配平可得,6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+X,根据钠、氯、氢原子个数守恒可得X为3NaCl、3NaOH;检验X溶液含有钠离子时,用铁丝蘸取溶液X,在酒精灯火焰上灼烧,火焰呈黄色;检验X溶液含有氯离子时,必须先排除氢氧根离子对氯离子检验的干扰,即取少量溶液X,加入足量稀HNO3,再滴加少量AgNO3溶液,出现白色沉淀,说明X溶液中含有Cl-。
考点:考查探究实验,涉及电解氯化铵和盐酸的化学方程式、除杂试剂的选择、解释创新装置的作用、离子方程式、氧化还原反应、滴定终点的现象、物质的量浓度、标准溶液的体积、物质的量及其在离子方程式中的应用、设计实验方案检验X溶液中钠离子的存在、设计实验方案检验X溶液中氯离子的存在等。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.| 50a |
| 13 |
| 50a |
| 13 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
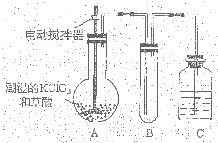 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com