
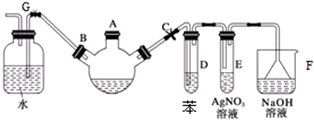
 .
.分析 实验室制备溴苯是用苯和液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和溴化氢,根据装置图可知,生成溴苯的同进还有溴化氢生成另外还有少部分溴挥发,所以在D装置中盛放苯吸收挥发出来的溴单质,E中的硝酸银会产生溴化银沉淀,尾气用氢氧化钠溶液吸收,关闭C打开F时,由于溴化氢极易溶于水,广口瓶中的水会倒吸入三颈烧瓶,
(1)根据溴苯的性质可知,溴苯是一种密度比水大的无色液体,在实验中因为溶解了不量的溴而显褐色,在三口烧瓶中铁与溴生成溴化铁,苯与溴在溴化铁作催化剂的条件下了生取代反应生成溴苯和溴化氢;
(2)根据溴易挥发及溴易溶于有机溶剂分析;溴化氢气体通入硝酸银溶液,能产生浅黄色沉淀;
(3)溴化氢极易溶于水,容易发生倒吸,溴苯不溶于水;
(4)三口烧瓶中的溴苯含有少量的溴和溴化氢,可以用NaOH溶液除去.
解答 解:实验室制备溴苯是用苯和液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和溴化氢,根据装置图可知,生成溴苯的同进还有溴化氢生成另外还有少部分溴挥发,所以在D装置中盛放苯吸收挥发出来的溴单质,E中的硝酸银会产生溴化银沉淀,尾气用氢氧化钠溶液吸收,关闭C打开F时,由于溴化氢极易溶于水,广口瓶中的水会倒吸入三颈烧瓶,
(1)在三口烧瓶中铁与溴生成溴化铁,苯与溴在溴化铁作催化剂的条件下了生取代反应生成溴苯和溴化氢,所以发生反应的化学方程式为: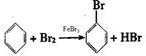 ,
,
故答案为: ;
;
(2)溴易挥发,且溴单质易溶于有机溶剂,则试管D的作用是吸收溴蒸汽;溴化氢溶于水和硝酸银反应生成溴化银淡黄色的,则试管E中现象为:出现淡黄色沉淀,且导管口有白雾,
故答案为:吸收溴蒸汽;出现淡黄色沉淀,且导管口有白雾;
(3)由于溴化氢极易溶于水,所以待三颈烧瓶中的反应进行到仍有气泡冒出时松开G夹,关闭C夹,可以看到的现象是与B相连的广口瓶中水流入三颈烧瓶,溴苯不溶于水,所以A中会出现分层,
故答案为:广口瓶中的水沿导管进入三颈烧瓶中、烧瓶中液体出现分层;
(4)三口烧瓶中的溴苯中含有少量的溴和溴化氢,可以用NaOH溶液除去,
故答案为:除去多余的Br2和未挥发的HBr.
点评 本题通过溴苯的制备,考查了制备方案的设计方法,为高考常见题型,题目难度中等,试题综合性强,难易适中,在注重对学生基础性知识考查和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的严谨规范的实验设计能力,也有利于提高学生的学科素养.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂的使用,可以降低反应的温度,起到节能的效果 | |
| B. | 中科院国家纳米科学中心宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 | |
| D. | 推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“APEC蓝” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③④ | B. | 仅②③④ | C. | 仅①③⑤ | D. | 仅②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
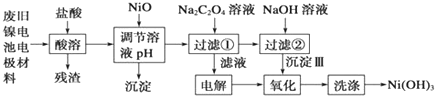
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
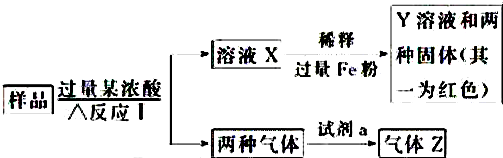
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、用电子式表示CJ2的形成过程:
、用电子式表示CJ2的形成过程: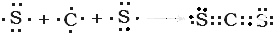
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com