
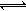 H2SO3;2H2SO3 + O2 = 2H2SO4(3)①1.6;酸;NaHSO3溶液中存在HSO3—
H2SO3;2H2SO3 + O2 = 2H2SO4(3)①1.6;酸;NaHSO3溶液中存在HSO3—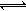 H+ + SO32—和 HSO3— + H2O
H+ + SO32—和 HSO3— + H2O 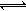 H2SO3 + OH—,HSO3—的电离程度大于其水解程度② 2NaHSO3 + O2 = Na2SO4 + H2SO4
H2SO3 + OH—,HSO3—的电离程度大于其水解程度② 2NaHSO3 + O2 = Na2SO4 + H2SO4 H2SO3;2H2SO3+O2=2H2SO4(3)①向Na2SO3溶液中通入SO2生成NaHSO3,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的硫酸根离子和生成硫酸氢跟离子的物质的量比为1:2,即溶液中参加反应的硫酸根为(1.0-0.2)mol?L-1,则生成的硫酸氢跟为2(1.0-0.2)mol?L-1="1.6" mol?L-1,硫酸氢跟电离产生氢离子,且电离程度大于水解程度,故溶液显酸性,NaHSO3溶液中存在HSO3—
H2SO3;2H2SO3+O2=2H2SO4(3)①向Na2SO3溶液中通入SO2生成NaHSO3,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的硫酸根离子和生成硫酸氢跟离子的物质的量比为1:2,即溶液中参加反应的硫酸根为(1.0-0.2)mol?L-1,则生成的硫酸氢跟为2(1.0-0.2)mol?L-1="1.6" mol?L-1,硫酸氢跟电离产生氢离子,且电离程度大于水解程度,故溶液显酸性,NaHSO3溶液中存在HSO3—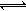 H+ + SO32—和 HSO3— + H2O
H+ + SO32—和 HSO3— + H2O 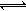 H2SO3 + OH—,HSO3—的电离程度大于其水解程度②向NaHSO3溶液中通入氧气,可将亚硫酸根离子氧化为硫酸根离子,反应方程式2NaHSO3 + O2 = Na2SO4 + H2SO4。
H2SO3 + OH—,HSO3—的电离程度大于其水解程度②向NaHSO3溶液中通入氧气,可将亚硫酸根离子氧化为硫酸根离子,反应方程式2NaHSO3 + O2 = Na2SO4 + H2SO4。

科目:高中化学 来源:不详 题型:单选题
| A.氨溶于水的喷泉实验,说明氨气极易溶于水 |
| B.常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化 |
| C.浓硝酸久置显黄色,说明浓硝酸具有不稳定性 |
| D.向胆矾中加入浓硫酸后出现白色的现象,说明浓H2SO4具有吸水性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸具有吸水性,因而能使蔗糖碳化 |
| B.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
| C.在反应SO2+2H2S=3S+2H2O中SO2作氧化剂 |
| D.硫粉在过量的纯氧中燃烧可以生成SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.湿润的蓝色石蕊试纸先变红后褪色 |
| B.左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D.本实验体现了二氧化硫的酸性、漂白性和弱氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.小于0.45 mol | B.等于0.45 mol |
| C.在0.45 mol和0.9 mol之间 | D.大于0.9 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.白色沉淀为BaSO3 | B.该实验表明FeCl3有还原性 |
| C.反应后溶液酸性增强 | D.反应后滴加KSCN溶液显红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖) 6C+6H2O 6C+6H2O |
| B.向AgNO3溶液中加入过量Na2S溶液后,再加NaCl稀溶液,黑色沉淀变成白色:Ag2S + 2Cl- =" 2AgCl↓+" S2- |
C.将NH3通入滴有酚酞的水中,溶液变红:NH3+ H2O  NH3·H2O NH3·H2O  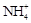 + OH- + OH- |
D.明矾的水溶液pH<7:Al3++ 3H2O  Al(OH)3(胶体)+3H+ Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.KMnO4(aq) | B.过量氨水 | C.石灰水 | D.盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com