
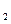 反应的化学方程式为
反应的化学方程式为科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 下表是元素周期表的一部分,请回答有关问题:
下表是元素周期表的一部分,请回答有关问题: 主族 周期 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | | | | ① | ② | | ③ | |
| 3 | | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | ④ | | | | | ⑩ | |
 (1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。 (2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的 质与⑨最高价氧化物的水化物反应的化学方程式
质与⑨最高价氧化物的水化物反应的化学方程式  (3)④元素与⑦元素形成化合物的电子式
(3)④元素与⑦元素形成化合物的电子式  (4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是  (填化学式)。
(填化学式)。 (5)③元素与⑩元素两者核电荷数之差是 。
(5)③元素与⑩元素两者核电荷数之差是 。 (6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。


| 实验步骤 | 实验现象与结论 |
| |       |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.r1 > r2 > r3 | B.r2> r1> r3 | C.r3 > r1 > r2 | D.r3 > r2 > r1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
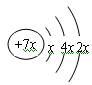 ,元素b形成的单质可以与CO2发生置换反应,原子序数b < c < a,b与d形成的化合物的电子式为
,元素b形成的单质可以与CO2发生置换反应,原子序数b < c < a,b与d形成的化合物的电子式为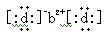 。下列比较中正确的是
。下列比较中正确的是| A.原子半径c < d | B.最高价氧化物对应的水化物的碱性b < c |
| C.四种元素在同一周期 | D.气态氢化物的稳定性a < d |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.② | B.①③⑤ | C.①②⑤ | D.③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com