
【题目】将铜放入稀硫酸中,再加入下列一种试剂,常温下就可产生气体的是:
A. CuSO4 B. FeCl3 C. KNO3 D. 浓H2SO4
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素剧期表的一部分,请根据要求填空

(1) 元素②最外层有_____个电子,在化合物中的最低负化合价为________;
(2) 元素⑤形成的离子的结构汞意图为_________;
(3) 用电子式表示元素①和⑦组成的化合物的形成过程:_______________;
(4) 元素④、⑤的最高价氧化物的水化物之间发生反应的离子方程式______________ 。
(5) 下列选项中能证明元素⑦的非金属性强于元素⑥的是________(双选)。
A.H2S的酸性弱于HCl B.S2-的还原性强于C1-
C.H2SO3的酸性强于HClO D.H2S不如HC1稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A. 由图甲可知,升高温度醋酸钠的水解程度增大
B. 由图乙可知,a点Kw的数值比b点Kw的数值大
C. 由图丙可知,反应A(g)+B(g) ![]() 2C(g)是吸热反应
2C(g)是吸热反应
D. 由图丁可知,反应C(金刚石,s)= C(石墨,s)的焓变△H=△H1—△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如下图所示,若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )
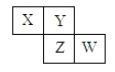
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 4种元素的单质中,Z单质的熔沸点最低
D. W单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图所示,对乙醇在各种反 应中应断裂的键说明不正确的是

A. 和钠作用键①断
B. 和浓H2SO4作用到170℃,键②和键⑤断
C. 和乙酸、浓H2SO4共热,键②断
D. 在Cu作用和O2反应,键①和键③断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。

请回答下列问题:
(1)写出下列物质的化学式:B_____________、丙____________;
(2)写出下列反应的化学方程式;
反应①_________________________________________________________________;
反应③_________________________________________________________________;
反应⑤_________________________________________________________________;
(3)向F的溶液中加入D溶液后产生的现象是________________________________,并用化学反应方程式解释产生此现象的原因____________________、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做制冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
2H2(g)+CO(g)![]() CH3OH(g)△H=-90.0kJ·mol-1①
CH3OH(g)△H=-90.0kJ·mol-1①
2CH3OH(g)![]() CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.1kJ·mol-1③
CO2(g)+H2(g)△H=-41.1kJ·mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO![]() CH3OCH3+CO2的热化学方程式为____________________。
CH3OCH3+CO2的热化学方程式为____________________。
(2)已知一些共价键的键能如下:
化学键 | H-H | C-H | C-O | O-H |
键能(kJ·mol-1) | 436 | 414 | 326 | 464 |
运用反应①计算一氧化碳中碳氧共价键的键能____________kJmol-1。
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com