
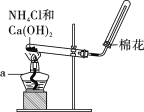
����Ŀ����ʵ�����������ͼ��ʾװ����ȡ���ռ���������ش��������⣺
(1)ԭ���뷽��
����ȡ�����Ļ�ѧ����ʽΪ__________________________________��
�ڸ��ռ������ķ���Ϊ________��
A�������ſ����� B�������ſ�����
(2)װ�������
����ͼ��װ����������ʵ�顣����a������Ϊ____________��
(3)˼���뽻��
������ȡ��״����4.48 L NH3��������ҪNH4Cl________g��
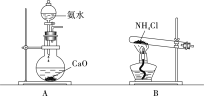
��ʵ������ȡ���������ɲ�����ͼ�е�______(�A����B��)��
���𰸡�2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O B �ƾ��� 10.7 A
CaCl2��2NH3����2H2O B �ƾ��� 10.7 A
��������
��1����ʵ�������ù�����ʯ�Һ��Ȼ�粒��������Ʊ�������
��NH3���ܶȱȿ���С��
��2������a������Ϊ�ƾ��ƣ�
��3�������ݻ�ѧ����ʽ��ʽ���㣻
��ʵ���һ����Խ�Ũ��ˮ���뵽��ʯ���п����Ʊ�������
��1����ʵ�������ù�����ʯ�Һ��Ȼ�粒��������Ʊ���������Ӧ�Ļ�ѧ����ʽΪ2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O���ʴ�Ϊ��2NH4Cl��Ca(OH)2
CaCl2��2NH3����2H2O���ʴ�Ϊ��2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O��
CaCl2��2NH3����2H2O��
��NH3���ܶȱȿ���С�������������ſ������ռ����ʴ�Ϊ��B��
��2������a������Ϊ�ƾ��ƣ��ʴ�Ϊ���ƾ��ƣ�
��3�����ɷ���ʽ�ɵ�NH4Cl��NH3����״��4.48LNH3�����ʵ���Ϊ0.2mol����NH4Cl�����ʵ���Ϊ0.2mol��NH4Cl������Ϊ0.2mol��53.5g/ mol=10.7g���ʴ�Ϊ��10.7��
��ʵ���һ����Խ�Ũ��ˮ���뵽��ʯ���п����Ʊ��������ʴ�Ϊ��A��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������Ľṹʽ��ͼ������W��X��Y��ZΪԭ��������������Ķ�����Ԫ�أ�Yԭ�Ӻ�������������������Ӳ�����3����X��Zλ�ڲ�ͬ�����ڣ������й�˵����ȷ����

A.��̬�⻯������ȶ��ԣ�X>Y
B.X��W��Z�����γɵĻ����ﶼ��Һ��
C.W2Y2�мȺ����Լ��ֺ��Ǽ��Լ�
D.ZԪ���γɵĺ�����ȫ����ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽�������仯����������Ժͻ�ԭ�ԣ�ijͬѧ���������ʵ�鷽�������з���ʵ��Ҫ������ȫ��ȷ���ǣ� ��
ѡ�� | ʵ����� | ʵ������ | ���ӷ�Ӧ | ʵ����� |
A | ���Ȼ�������Һ��ͨ������ | dz��ɫ��Һ����ػ�ɫ��Һ | 2Fe2����Cl2=2Fe3����2Cl�� | Fe2�����л�ԭ�� |
B | ���Ȼ�������Һ�м���пƬ | dz��ɫ��Һ�����ɫ��Һ | Fe2����Zn=Fe��Zn2�� | Fe2�����л�ԭ�� |
C | ���Ȼ�����Һ�м������� | �ػ�ɫ��Һ���dz��ɫ��Һ | Fe3����Fe=2Fe2�� | �����ʾ��л�ԭ�� |
D | ���Ȼ�����Һ�м���ͭ�� | ��ɫ��Һ����ػ�ɫ��Һ | 2Fe3����Cu=2Fe2����Cu2�� | Fe2������������ |
A.AB.BC.CD.D
���𰸡�A
��������
A�����Ȼ�������Һ��ͨ��������dz��ɫ��Һ����ػ�ɫ��Һ��˵��Fe2�����л�ԭ�ԣ����������ӷ�ӦΪ2Fe2����Cl2=2Fe3����2Cl������A��ȷ��
B�����Ȼ�������Һ�м���пƬ��dz��ɫ��Һ�����ɫ��Һ��˵��Fe2�����������ԣ����������ӷ�ӦΪFe2����Zn=Fe��Zn2������B����
C�����ӷ���ʽ��ɲ��غ㣬��ȷ�����ӷ���ʽΪ2Fe3����Fe=3Fe2������C����
D�����Ȼ�����Һ�м���ͭ�ۣ���Һ��ɫӦ���ػ�ɫ�����ɫ����D����
�ʴ�ΪA��
�����͡���ѡ��
��������
18
����Ŀ��ij��ɫ�Ļ��������п��ܺ���NO2��NO��CO2��O2��NH3��N2�еļ��֣���100mL�����徭����ͼ��ʾ��ʵ��װ�ý��д���������õ�������Һ��������������ʣ�࣬�����������Ϊ(������Na2O2��NO2��NO�ķ�Ӧ)�� ��

A.NO2��CO2��N2B.NH3��NO��CO2
C.NH3��N2��CO2D.NO��O2��NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʵ���ҳ��õ���������ijʵ��С���Ʊ�������أ�����������ͼ��

ʵ��һ������ص��Ʊ�����ȡ3.0 g KClO3����� 7. 0 g KOH�����ϣ�����������С����ȣ�����������ں����������Ͻ��裬�ټ���4.0g MnO2 �������ȡ�
(1)����ʱ���� MnO2 �������з�Ӧ�Ļ�ѧ����ʽΪ _____________��
(2)�����������ò����������ԭ����______________ ��
ʵ���������ص��绯��������������������ձ��У���ˮ�����ȡ��ȡ���������������շ���������������Һ��ͨ��CO2��ֱ����Һ��ɫȫ����Ϊ��ɫΪֹ�����ó�������ɰо©�����г��ˣ�����Һ���绯��Ӧʵ��װ����ͼ��ʾ��

(3)�����շ������м����״�����λ��_______ ��ѡ����ĸ��a����b������ c��)�����������ŵ��Ƿ�����Ʒ�Ӧ�ķ�����ֹͣ����ԭ����_____________��
(4)�ձ���������绯��Ӧ�Ļ�ѧ����ʽΪ___________________��
(5)������绯ʱ������������� CO2��ԭ����_______________ ��
ʵ����������ص�Ũ���ᾧ������Һת�����������У�����Ũ������Ȼ��ȴ�ᾧ���������ɡ�������ת������֪�����ı������ϣ���������� 80�� �����Сʱ���ң���ȴ����������Ʒ����Ϊ 3.16 g��
(6)����Ũ����Һ��___________ֹͣ���ȡ�
(7)��ʵ��С���Ʊ�������صIJ�����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֹ��ϵĸ���ֵ�����Դ��Ŀǰ��������������ڽ�����Ⱦ���ŷŵ�̼��Դ���ɳ�����Ч���ŷŵ�����Դ�����ܿ������������������ڣ�
һ����ȼ�ϵ��Ʊ�
(1)�ҹ���������Ҫ��Դ�ǽ�¯�����⣬���Ƶõ��������н϶��CO��H2S�����¸ɷ�������������������Ԫ��ת��Ϊ�������ɷ�����ķ�Ӧ����ʽΪ________��
(2)�ҹ�������Ա��ľмˮ����������ȡ��ȼ�ϣ���һ�������£���Ӧ���д������·�Ӧ��
i.CO2 (g) +C(s)=2CO (g) ��H1
ii.C(s) + H2O(g)=CO ( g) + H2 (g) ��H2
iii.C(s) + 2H2 (g)=CH4( g) ��H3
iv.CO(g) + H2O(g)=CO2 ( g) + H2 (g) ��H4
v. CH4(g)+ 2 H2O(g)= CO2 ( g) + 4H2 (g) ��H5
�١�H5=_________________ ��
���о��� CaO ������������CaO ��������Ca ����ľм����̼�����ʵ�����ȷ������750�棬����ˮ��������Ϊ 0.lg/(ming)�£�̽�������������Բ�����ֺ��������ܵ�Ӱ�죬��������ʾ��
n(Ca)/n(C) | ����������� | ̼ת����/% | |||
H2 | CO | CO2 | CH4 | ||
0 | 45.58 | 22.70 | 22.37 | 7.54 | 61.22 |
0.5 | 52.95 | 21.74 | 19.11 | 5.14 | 56.59 |
1.0 | 58.62 | 22.37 | 12.60 | 5.31 | 61.42 |
�ɱ������ݣ�n(Ca) / n(C) =___ʱ��Ϊ������ n(Ca) / n(C) ��0��0.5ʱ��H2����������������ӵ�ԭ��_____����ϵ�������¶Ȳ�����ľм���Ƚ�������Ӧ��Ӱ�� �����Ҷ� CaO ���� CO2 �������Լ� CaCO3�ķֽⷴӦҲ�кܴ�Ӱ�졣ʵ������У����� n(Ca) / n(C) Ϊ 1.0��ˮ��������Ϊ0.1 g/(min g)�� ��������Ӧ�¶ȴ�700������850�棬�����¶ȶԲ����ʡ������ʵ�Ӱ�������
�¶�/�� | ����������� | ̼ת����/% | ||
H2 | CO | CO2 | ||
700 | 51.78 | 20.75 | 19.89 | 54.37 |
750 | 58.62 | 22.37 | 12.60 | 61.42 |
800 | 55.63 | 26.05 | 12.71 | 73.43 |
850 | 54.16 | 26.94 | 13.82 | 83.34 |
�۴Ӳ����ʵĽǶȿ��ǣ���Ѳ����¶���________________��
�����ŷ�Ӧ�Ľ��У����� CaO �������������ͣ�ԭ����___________��
������ȼ�ϵĴ洢
(3)������������Һ��ȼ���У����Խ�������İ�ȫ��Ч�洢���������⡣���ڼ״����е�λ����������ߡ���¶ȵ͵��ŵ㣬�������Һ�崢��ƽ̨���ӡ��ҹ�ѧ�߹���һ��˫���ܽṹ�Ĵ�������Ӧ�����У��ڴ����ı���ͬʱ�ˮ�ͼ״�����ͼ�Ǽ״�����ת���ķ�Ӧ����( TS ��ʾ����̬����
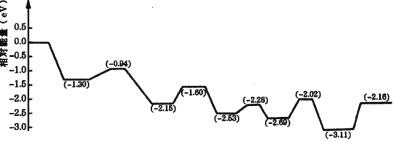
����ͼ���жϼ״����ⷴӦ�ж��ѵĻ�ѧ����______���÷�Ӧ�ġ�H___0( ������������������������С����)
������ȼ�ϵ�Ӧ�á�һ�����ܵ�ص�ԭ����ͼ��
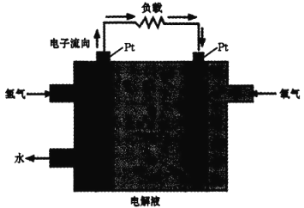
(4)�����ĵ缫��ӦʽΪ________���� Pt �缫���澵һ��ϸС��Ǧ�ۣ�ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1mol��CnHmCOOH����ʾ������ӳ�ʱ��50.8g�⣬0.1mol��������ȫȼ��ʱ������CO2��H2O��3.4mol���������ǣ�������
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϳ�1,2-���������ʵ��װ����ͼ��ʾ������˵��������ȷ����
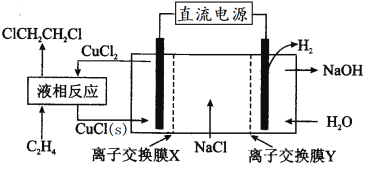
A.��װ�ù���ʱ�������ĵ缫��Ӧ��CuCl(s)+Cl--e-=CuCl2
B.Һ�෴ӦΪCH2=CH2+2CuCl2=ClCH2CH2Cl+2CuCl(s)
C.X��Y����Ϊ�����ӽ���Ĥ�������ӽ���Ĥ
D.��װ���ܷ�ӦΪCH2=CH2+2NaCl+2H2O![]() ClCH2CH2Cl+2NaOH+H2��
ClCH2CH2Cl+2NaOH+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��������У�A��B��C��D��E������ͬһ�ֶ�����Ԫ�أ�����A�ǵ��ʣ�B����������̬�⻯�C��D�������E��D��ˮ��Ӧ�IJ���������֮��ͨ��һ����Ӧ����ʵ�ֱ�����ʾת������ ( )
���ʱ�� | ����ת����ϵ | A | D | E |
�� |
| Si | SiO2 | Na2SiO3 |
�� | S | SO3 | H2SO4 | |
�� | Na | Na2O2 | NaOH | |
�� | N2 | NO2 | HNO3 |
A���ڢ� B���ڢ� C���٢ۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�İ뵼�����֮һ��̼���衢��λ��ͬ���塣
��1����̬��ԭ�ӵļ۲�����Ų�ʽΪ__________________��
��2�����־�����۵��Ӳ�������ʾ��
���� | ���ʯ | ̼���� | �������� | �� | �� |
�۵�/�� | 3 550 | 2 700 | 1 710 | 1 410 | 1 211 |
Ӳ�� | 10 | 9.5 | 7 | 6.5 | 6.0 |
��̼����ľ���������__________________��
������������۵�ܸߣ����ɱ�(���������̼)������������Ҫԭ����__________________��
������۵������ģ�����Ҫԭ����___________________________��
��3��![]() �����幹����________________��GeCl4����������ӻ�������__________________��
�����幹����________________��GeCl4����������ӻ�������__________________��
��4��1��CS2�����к�_________��������
��5����������ᄃ����ͼ��ʾ����֪�����������Ħ������ΪM g��mol1��NA���������ӵ�������ֵ�������ܶ�Ϊ �� g��cm3���þ����Ļ�ѧʽΪ_________����ԭ�ӵ���λ��Ϊ_________���þ�������Ϊ_________cm(�ô���ʽ��ʾ)��
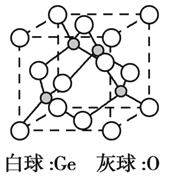 ��
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com