
����Ŀ��һ���¶��£���2L���������г���1molA��1molB��������ӦA��g��+B��g��=C��g������һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ�������������¶�˵����ȷ���ǣ�������
t/s | 0 | 5 | 15 | 25 | 35 | |
n��A��/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.ǰ 5 s ��ƽ����Ӧ����v��A��=0.03 molL��1s��1
B.����Ӧ�����ȷ�Ӧ
C.�����¶Ȳ��䣬��ʼʱ�������г���2molC����ƽ��ʱ��C��ת���ʴ���80%
D.�����¶Ȳ��䣬��ʼʱ�������г���0.2molA��0.2molB��1molC����Ӧ�ﵽƽ��ǰv��������v���棩
���𰸡�D
���������⣺��2L���������г���1molA��1molB��������ӦA��g��+B��g��=C��g������һ��ʱ���ﵽƽ�⣬�ɱ������ݿ�֪25s�ﵽƽ�⣬��
A��g��+ | B��g��= | C��g�� | |
��ʼ | 0.5 | 0.5 | 0 |
ת�� | 01 | 0.1 | 0.1 |
ƽ�� | 0.4 | 0.4 | 0.1 |
A��ǰ 5 s ��ƽ����Ӧ����v��A��= ![]() =0.015 molL��1s��1����A����
=0.015 molL��1s��1����A����
B������Ϣ�����жϷ�Ӧ�������仯������ȷ���Ƿ�Ϊ���ȡ����ȷ�Ӧ����B����
C�������¶Ȳ��䣬��ʼʱ�������г���2molC������ת��Ϊ��Ӧ���ԭ��ʼ����ͬ��ԭƽ��ʱA��ת����Ϊ ![]() ��100%=20%������ʼʱ�������г���2molC����ƽ��ʱ��C��ת����Ϊ80%����C����
��100%=20%������ʼʱ�������г���2molC����ƽ��ʱ��C��ת����Ϊ80%����C����
D��K= ![]() =0.625��Qc=
=0.625��Qc= ![]() =50��Qc��K��ƽ�������ƶ�����Ӧ�ﵽƽ��ǰv��������v���棩����D��ȷ��
=50��Qc��K��ƽ�������ƶ�����Ӧ�ﵽƽ��ǰv��������v���棩����D��ȷ��
��ѡD��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��ļ���(��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%)��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�dz��������л���ı���ģ��ʾ��ͼ������˵����ȷ���ǣ� �� 
A.����ʹ���Ը��������Һ��ɫ
B.�ҿ�����ˮ����ȡ����Ӧʹ��ˮ��ɫ
C.���е�̼̼���ǽ���̼̼������̼̼˫��֮��Ķ��صĹ��ۼ�
D.�������ᶼ�ܷ��������кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾʵ��װ�ý���SO2���ʵ�̽��ʵ�飮 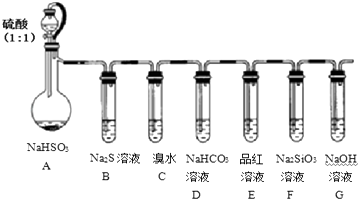
��1��װ��A�з�����Ӧ�����ӷ���ʽΪ�� �� Gװ�õ����� ��
��2����������װ�������Եķ��� ��
��3���ܹ�֤��SO2���л�ԭ�ԡ������Ե�ʵ��װ������Ϊ��������ĸ��ʾ�����۲쵽�������������� ��
��4����Ҫ֤�����ԣ�H2CO3��H2SiO3 �� ��Ӧ�۲쵽��ʵ�������� ��
��5��ijͬѧ��32gCu��50g 98%Ũ���ᷴӦ����ȡSO2 �� ʵ���������19.2g��Cuʣ�࣬��Ҫ��Cu��ȫ�ܽ⣬������Ӧ����1mol/L��ϡ����mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���ӦX��g��+3Y��g��2Z��g����H=��92.4 kJ/mol��X��ƽ��ת���ʣ���������ϵ��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� �� 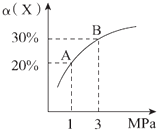
A.ͼ��A��B���㣬�ﵽ��ͬ��ƽ����ϵ
B.������Ӧ�ڴﵽƽ�������ѹǿ��H2��ת�������
C.�����¶ȣ�ƽ�����淴Ӧ�����ƶ���˵���淴Ӧ������������Ӧ���ʼ�С
D.��1.0 mol X��3.0 mol Y������1 L�ܱ������з�����Ӧ���ų�������Ϊ92.4 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�����CO2�ϳ�CH3OH�ķ�Ӧ���£� CO2��g��+3H2��g��H3OH��g��+H2O��g����H1 ��
�о����֣���Ӧ�����л��и���Ӧ��
CO2��g��+H2��g��CO��g��+H2O��g����H2 ��
�¶ȶ�CH3OH��CO�IJ���Ӱ����ͼ��ʾ������˵���У�����ȷ���ǣ� ��
A.��H1��0����H2��0
B.����ѹǿ�����ڼӿ�ϳɷ�Ӧ������
C.���������У��¶�Խ��Խ���������CH3OH�IJ���
D.�ϳ�CH3OH��Ӧ��ƽ�ⳣ������ʽ��K= ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������У�2A��g��+B��g��![]() 2C��g��+D��g��������������A��B����4mol����ǰ10s A��ƽ����Ӧ����Ϊ0.12mol/��L��s������10sʱ��������B�����ʵ����ǣ�������
2C��g��+D��g��������������A��B����4mol����ǰ10s A��ƽ����Ӧ����Ϊ0.12mol/��L��s������10sʱ��������B�����ʵ����ǣ�������
A. 3.4 mol B. 3.2 mol C. 2.8 mol D. 1.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�����ͨ���ۺ�ˮ������Ӧ�����Եõ�������������������ֿ��Ծ����˷�Ӧ���淴Ӧ�����ɿ�����ϸ�����ۣ��������۾��кܸߵķ�Ӧ���ԣ��ڿ�������ײ��������ʱ��ȼ�գ������׳ơ�������������ֱ�������ͼ��ʾ����������װ�ã���ȡ��������������͡�����������ʵ���б���ʹ����ͨ���ۺ�6 mol/L�����ᣬ�����Լ���ѡ(װ���б�Ҫ������̨�����С���Ȧ��ʯ�����������豸����ͼ�о�����ȥ)��
 ������
������
��д���пհף�
��1������ʵ��ʱ���Թ�A��Ӧ������Լ���______����ƿB��������______����ƿC��������______�����Թ�D���ռ��õ�����______(������)��
��2��ʵ��ʱ��U�ι�G��Ӧ������Լ���________������©��H��Ӧ����_______��
��3������װ���У���ʵ��ʱ��Ҫ���ȵ�������(���������Ӧ����ĸ)________��
��4���Թ�E�з�����Ӧ�Ļ�ѧ����ʽ��_____________��Ϊ�˰�ȫ����E���з�Ӧ����ǰ����F���ڴ�����_____
��5�����ʵ��֤����Ӧ��A�ܹ�������Fe3+ ��������Ҫ�IJ���������_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ͼ�л������˵��������ǣ� �� 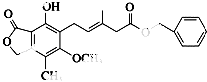
A.�û�������Br2�ܷ����ӳɷ�Ӧ��ȡ����Ӧ
B.1 mol�û�������NaOH��Һ��Ӧʱ�������3 mol NaOH
C.�û�������ʹ���Ը��������Һ��ɫ
D.�û������ܺ�Na2CO3��Һ��Ӧ�ų�CO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com