
【题目】下列元素中金属性最强的是
A. K B. Mg C. A1 D. Si
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为NaCl+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应的化学方程式是______________________;利用电解所得气体制36.5%的浓盐酸1 000 t,最少需消耗食盐________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,对其进行开发利用的部分流程如右图所示。下列说法不正确的是

A. 可用Na2CO3溶液除去粗盐中的Ca2+
B. 从成本考虑,试剂1选用NaOH溶液
C. 从苦卤中提取Br2的反应的离子方程式为2Br—+C12===2C1—+Br2
D. 工业上,电解熔融MgCI2冶炼金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体。由此他提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式:____________________。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是___________,它与溴水反应的化学方程式是___________________,在验证过程中必须全部除去。
(4)请你选用下列四个装置(见下图,可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
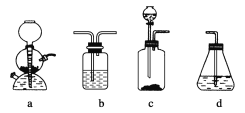

(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性。理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )

A. 元素b位于第ⅥA族,有+6、-2价两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c>d
D. 元素c和e的气态氢化物的稳定性:c>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | H | J | ||||
3 | B | C | D | G | I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________,氧化性最强的单质是________,还原性最强的单质是________。
(2)最高价氧化物对应的水化物中,碱性最强的是________,酸性最强的是________,呈两性的是________。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________。
(4)在B、C、D、G、I中,原子半径最大的是________。
(5)元素C与I形成的化合物的电子式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知使用林德拉催化剂(Pd/PbO、CaCO3)可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示的仪器组装而成的实验装置(铁架台未画出),由乙炔制得乙烯,并测定在氢化反应中乙炔的转化率。若用含0.020 mol CaC2的电石和含1.30 g锌的锌粒(杂质不与酸反应)分别与足量的饱和食盐水和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水的体积为V mL(忽略乙炔在水中溶解的部分)。试回答下列问题:

(1)各装置的连接顺序为
a→______→______→______→_____→______→______→h。
(2)分别写出A中和C中所发生反应的化学方程式:
A:______________________。
C:______________________。
(3)装置A中产生气体的反应速率往往太快,为了减慢反应速率,操作时还应采取的措施是__________________________。
(4)G所选用的量筒的容积较合理的是____________(填写选项字母)。
A.500 mL B.1000 mL C.2000 mL
(5)若V=672(导管内气体体积忽略不计),则乙炔的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、二氧化碳、三氧化硫同时具备的性质是( )
A.都能使品红试液褪色
B.都能和氢氧化钠溶液反应生成盐和水
C.都有刺激性气味
D.常温下都是气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com