
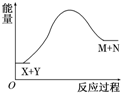
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
分析 A.由图可知,生成物的总能量大于反应物的总能量,而不是某一种反应物或生成物的能量关系;
B.吸热反应不一定在加热的条件下发生;
C.该反应为吸热反应,△H=破坏反应物中的化学键所吸收的能量-形成生成物中化学键所放出的能量>0;
D.加入催化剂,正、逆化学反应速率同等程度的增大.
解答 解:A.由图可知,M和N的总能量大于X和Y的总能量,不能说明X的能量一定低于M的能量,Y的能量一定低于N的能量,故A错误;
B.吸热反应不一定在加热的条件下发生,比如氯化铵和十水合氢氧化钡的反应就是吸热反应,但是不需加热条件就能发生,故B错误;
C.由图可知,生成物的总能量大于反应物的总能量,该反应为吸热反应,所以破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,故C正确;
D.加入催化剂,正、逆化学反应速率同等程度的增大,因此加入催化剂可增大正反应速率和逆反应速率,故D错误;
故选C.
点评 本题考查吸热反应与放热反应,可以根据能量守恒从反应物与生成物的总能量、化学键的断裂与形成两个角度进行理解,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+:1s22s22p6 | B. | F:1s22s22p5 | ||
| C. | Cl-:1s22s22p63s23p5 | D. | Mn:1s22s22p63s23p63d54s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间 | CO2 (mol) | H2 (mol) | CH3OH (mol) | H2O (mol) |
| 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中X为还原产物 | |
| B. | X能使溴水褪色,说明X具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为6.02×1023 | |
| D. | 该反应生成的气体通入足量Ba(NO3)2溶液中,可得到两种沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉辨别真假葡萄酒 | |
| B. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| C. | 金属的防护中,牺牲阳极的阴极保护法利用的是原电池原理 | |
| D. | 84消毒液在日常生活中广泛应用,其有效成分是Ca(ClO)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应:
用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com