
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式: 。
(2)硒为第四周期VI A族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为 (用元素符号表示)。SeO3分子的立体构型为 。
(3)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 。

(4)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为 。
(5)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式: 。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞参数为a pm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:选择题
化学与生产生活密切相关,下列说法正确的是
A.碳酸钡可用于制治疗胃酸过多的药
B.二氧化硫可用作食品的漂白剂
C.碳纤维是复合材料
D.PM2.5指数是雾霾天气监测中的重要指标
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第三次月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.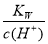 =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如下图(Ⅰ)所示。若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列叙述正确的是

A.2min内A的化学反应速率为0.1 mol/(L•min)
B.在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C.在反应达平衡时,其他条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D.图(I)中,达平衡时,A的体积分数为37.5%
查看答案和解析>>
科目:高中化学 来源:2016届宁夏固原一中高三上适应性训练理综化学试卷(解析版) 题型:选择题
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是
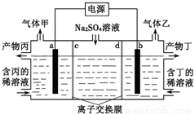
A.a极与电源的负极相连
B.产物丙为硫酸溶液
C.离子交换膜d为阴离子交换膜
D.a电极反应式:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上12月模拟化学试卷(解析版) 题型:选择题
下列分子中所有原子都满足最外层8电子结构的是
①CO2 ②XeF6 ③PCl3 ④SO2 ⑤BF3 ⑥N2 ⑦P4 ⑧PCl5
A.①③⑥⑦ B.①④⑤ C.①④⑥ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省宜春市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列物质中,既能导电又属于电解质的是
A.蔗糖 B.熔融的氯化钠 C.氯化氢气体 D.锌片
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(普通班)化学试卷(解析版) 题型:填空题
碳、氮及其化 合物在工农业生产生活中有着重要作用。请回答下列问题:
合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道 ,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下: Fe2O3(s) + 3CH4(g)
,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下: Fe2O3(s) + 3CH4(g)  2Fe(s) + 3CO(g) +6H2(g) ΔH>0
2Fe(s) + 3CO(g) +6H2(g) ΔH>0
① 若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为 _________ 。
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是_____(选填序号)
a.CH4的转化率等于 CO的产率
CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③ 该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA____KB(填“>”、“ <”或“=”)。纵坐标可以表示的物理量有哪些 。
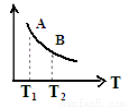
a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
100mL浓度为2mol/L的盐酸跟略过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量醋酸钠溶液 D.加入适量的NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com