�������˻ᡰ���ơ����ȼ���DZ��飨C3H8��������������˻���ȼ���DZ�ϩ��C3H6������֪��C3H8(g)+5O2(g)����3CO2(g)+4H2O(l)+2220.0kJ C3H6(g)+4.5O2(g)����3CO2(g)+3H2O(l)+2049kJ����˵����ȷ����
- A.
1molC3H8(g)��5molO2(g)��Ӧ����3molCO2(g)��4molH2O(g)�ų���������2220.0kJ
- B.
1molC3H6��4.5molO2��Ӧ����3molCO2��3molH2O�ų���������2049.0kJ
- C.
������Ӵ�����������ڱ�ϩ����
- D.
����ת��Ϊ��ϩ�Ĺ�����һ�����ȹ���
C
A��ˮ��Һ̬�����壬�����������ʷų�������С��2220.0KJ��
B��û��˵�����ʵľۼ�״̬���ر���ˮ�ģ��ʲ����жϣ�
C������ų��������࣬��������
D����������������ڱ�ϩ�����Ƿ��ȹ���
��ϰ��ϵ�д�
���ϰ��
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
�������ӷ���ʽ��д��ȷ����
- A.
��FeBr2��Һ��ͨ������������2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
- B.
��ʯī�缫���ϵ��NaCl������Һ��2Cl
-+2H
2O

Cl
2��+H
2��+2OH
- - C.
��CaCl2��Һ��ͨ�������̼���壺Ca2++CO2+H2O=CaCO3+2H+
- D.
������п����Ӧ��2H++Zn2+=H2��+Zn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
����ʵ�鱨���¼��ʵ��������ȷ����
| ʵ�� | 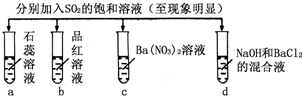 |
��
¼ | | a | b | c | d |
| A | ��ɫ | ����ɫ | ��ɫ��Һ | ��ɫ��Һ |
| B | ��ɫ | ��ɫ | ��ɫ���� | ��ɫ���� |
| C | ��ɫ | ��ɫ | ��ɫ��Һ | ��ɫ���� |
| D | ��ɫ | ��ɫ | ��ɫ���� | ��ɫ��Һ |
- A.
A
- B.
B
- C.
C
- D.
D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
���и����е�������������ʱ����Ӧ�����ı��Ӧ�������ı䣬���������������仯����
- A.
Na��O2
- B.
Fe��Cl2
- C.
Na2O2��CO2
- D.
C��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
���������������
- A.
ȷ��ȡ20.00mL���������Һ����ѡ��25 mL��ʽ�ζ���
- B.
��ˮ���ȣ�Kw����pH���
- C.
�ö��Ե缫���1 LŨ�Ⱦ�Ϊ2 mol/L��AgNO3��Cu(NO3)2�Ļ����Һ������0.2 mol����ת��ʱ����������6.4g����
- D.
c(NH4+)��ȵ�(NH4)2SO4��Һ��(NH4)2CO3��Һ��NH4Cl��Һ��c[(NH4)2SO4]��c[(NH4)2CO3]��c(NH4Cl)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
������Һ��Ϊ0.100mol/L�����й�ϵ��ȷ����
�� NH4Cl �� NH4HSO4 �� NH4Fe(SO4)2 �� NH3��H2O
- A.
�٢������ԣ��ۢ��Լ���
- B.
c(NH4+)���ܣ��ۣ���
- C.
��Һ��pH���٣��ڣ���
- D.
����Һ�У�c(NH4+)+c(H+)=c(SO42-)+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
��ڵġ���п����������������ȫ����������Ԫ�أ����������١���˥�ϵ����á���������(SeO2)��һ�����������䱻��ԭ��ĵ��������ܳ�Ϊ������Ⱦ�ͨ����ŨHNO3��ŨH2SO4��Ӧ����SeO2�Ի���Se���ڻ��չ��̵����漰������������ѧ��Ӧ
��SeO2+4KI+4HNO3==Se+2I2+4KNO3+2H2O��
�� Se+2H2SO4(Ũ)==2SO2��+SeO2+2H2O��
�����й�������ȷ����
- A.
SeO2��H2SO4(Ũ)��I2����������ǿ������˳����H2SO4(Ũ)> SeO2> I2��
- B.
����Se���������I2�ǻ�ԭ����
- C.
��Ӧ����KI����������SeO2�ǻ�ԭ��
- D.
��Ӧ����ÿ��1.0 mol I2���ɣ�ת�Ƶ�����ĿΪ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
�ڼ��ձ��з������ᣬ���ձ��з�����ᣬ������Һ�������pH����ȣ������ձ���ͬʱ�����������������ͬ����п��������˵����ȷ����
- A.
��Ӧ���������ձ��еõ������������
- B.
��Ӧ���������ձ��еõ���������
- C.
��Ӧ��ʼʱ���ձ��л�ѧ��Ӧ�������
- D.
��Ӧ��ʼ����ձ��л�ѧ��Ӧ���ʿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
������һ�ָ�Ч��������Դ��0.25mol������ȫȼ������Һ̬ˮʱ�ų�222.5kJ�������������Ȼ�ѧ����ʽ����ȷ����
- A.
2CH4(g) + 4O2(g) ==2CO2(g) + 4H2O(l) ��H= +890 kJ��mol-1
- B.
CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ��H= +890 kJ��mol-1
- C.
CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ��H=-890 kJ��mol-1
- D.
2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ��H == -890 kJ��mol-1
�鿴�𰸺ͽ���>>


 Cl2��+H2��+2OH-
Cl2��+H2��+2OH-