
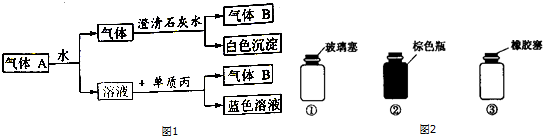
分析 单质丙和溶液C反应生成蓝色溶液,则该蓝色溶液中含有铜离子,气体A和水反应生成C溶液,则C溶液应该是酸,则丙是Cu,铜和稀硝酸在常温下反应,则C是HNO3,气体B是NO,根据元素守恒知,A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,根据元素守恒及物质颜色知,甲是C,乙是浓硝酸,则A中含有CO2、NO2,
(1)甲为C,乙为浓硝酸,白色沉淀为CaCO3;
(2)甲与乙反应是碳和浓硝酸加热反应生成二氧化碳、二氧化氮和水;
(3)若将Cu投入到显黄色的乙的浓溶液中,反应后铜丝有剩余,开始铜和浓硝酸反应生成硝酸铜、二氧化氮和水,随反应进行浓硝酸变化为稀硝酸,铜和稀硝酸反应生成硝酸铜、一氧化氮和水;
(4)浓硝酸见光易分解,是易挥发的液体,实验室盛放少量硝酸的浓溶液需要密闭,遮光,存放在玻璃塞的细口棕色试剂瓶.
解答 解:单质丙和溶液C反应生成蓝色溶液,则该蓝色溶液中含有铜离子,气体A和水反应生成C溶液,则C溶液应该是酸,则丙是Cu,铜和稀硝酸在常温下反应,则C是HNO3,气体B是NO,根据元素守恒知,A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,根据元素守恒及物质颜色知,甲是C,乙是浓硝酸,则A中含有CO2、NO2,白色沉淀为CaCO3,
(1)通过以上分析知,甲为C,乙为浓硝酸,白色沉淀为CaCO3,
故答案为:C;浓硝酸;CaCO3;
(2)甲与乙反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)若将Cu投入到显黄色的乙的浓溶液中,反应后铜丝有剩余,开始铜和浓硝酸反应生成硝酸铜、二氧化氮和水,反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O,随反应进行浓硝酸变化为稀硝酸,铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(4)浓硝酸见光易分解,是易挥发的液体,实验室盛放少量硝酸的浓溶液需要密闭,遮光,存放在玻璃塞的细口棕色试剂瓶,选择②,反应的化学方程式为:4HNO3(浓)$\frac{\underline{\;光照或加热\;}}{\;}$O2↑+4NO2↑+2H2O,
故答案为:②;4HNO3(浓)$\frac{\underline{\;光照或加热\;}}{\;}$O2↑+4NO2↑+2H2O.
点评 本题考查无机物的推断,涉及碳、氮元素单质及化合物的性质,E溶液为蓝色是推断的突破口,据此可以推断丙,再结合转化关系确定乙为硝酸,熟练掌握元素化合物的性质是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去FeCl3溶液中的FeCl2杂质可以向该溶液中加入过量的铁粉 | |
| B. | 过量的Fe与Cl2反应,一定生成FeCl3 | |
| C. | Fe3O4可用于生产红色油漆或红色涂料 | |
| D. | 普通钢铁是合金,不锈钢是特种钢,不是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的还原性依次增强 | B. | I2、Br2、Cl2的氧化性依次增强 | ||
| C. | H2O、H2S、HCl热稳定性依次增强 | D. | H3PO4、H2SO3、HClO的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X生成的速率与Z分解的速率相等 | |
| B. | 单位时间生成a mol X,同时生成3a mol Y | |
| C. | X、Y、Z的浓度不再变化 | |
| D. | X、Y、Z的分子数比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO4>H2CO3>H2SiO3 | B. | H2CO3>H2SiO3>H3PO4 | ||
| C. | H2SiO3>H3PO4>H2CO3 | D. | H2SiO3>H2CO3>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com