
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. ;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式).
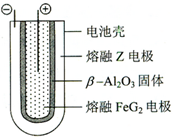
;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式). Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极. 分析 X、Y、Z、M、G五种分属三个短周期元素,且原子序数依次增大.则X为氢元素;X、Z同主族,Y、M同主族,Z、X可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G的原子序数最大,结合(4)中G与Fe形成的化合物FeG2,则G为Cl元素,据此解答.
解答 解:X、Y、Z、M、G五种分属三个短周期元素,且原子序数依次增大.则X为氢元素;X、Z同主族,Y、M同主族,Z、X可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G的原子序数最大,结合(4)中G与Fe形成的化合物FeG2,则G为Cl元素.
(1)Y为O元素,价电子排布式为2s22p4,SO3中S原子价层电子对数=3+$\frac{6-2×3}{2}$=3,S原子采取sp2杂化,
故答案为:2s22p4;sp2;
(2)NaH的电子式为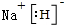 ;非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是硫化物 H2S,
;非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是硫化物 H2S,
故答案为: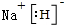 ;H2S;
;H2S;
(3)H2S的燃烧热△H=-a kJ•mol-1,H2S燃烧反应的热化学方程式:2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l),△H=-2aKJ•mol-1,
故答案为:2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l),△H=-2aKJ•mol-1;
(4)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2 Fe+2NaCl,放电时,为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe;充电时,为电解池,阴极发生还原反应,故Na电极接电源的负极,
Fe+2NaCl,放电时,为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe;充电时,为电解池,阴极发生还原反应,故Na电极接电源的负极,
故答案为:Fe2++2e-=Fe;钠.
点评 本题以元素推断为载体,考查了元素化合物的性质、核外电子排布、电子式、杂化轨道、热化学方程式、电化学等,能正确判断元素是解本题的关键,注意(2)中NaH电子式书写中氢负离子的2个电子成对,不能分开.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
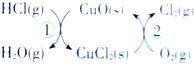 示).
示).| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
| NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
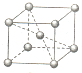 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
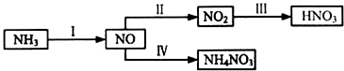
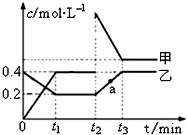
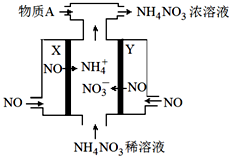
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com