
| A. | 400mL | B. | 500mL | C. | 450mL | D. | 无法确定 |
分析 当加入的氢氧化钠使铁元素完全沉淀恰好沉淀,所需的氢氧化钠溶液体积最小,此时溶液中溶质为硝酸钠,根据钠离子守恒有n(NaOH)=n(NaNO3),根据氮元素守恒有n(NaNO3)+n(NO)=n(HNO3),据此计算n(NaOH),再根据V=$\frac{n}{c}$计算.
解答 解:当加入的氢氧化钠使铁元素完全沉淀恰好沉淀,所需的氢氧化钠溶液体积最小,此时溶液中溶质为硝酸钠,根据氮元素守恒有:n(NaNO3)+n(NO)=n(HNO3),
故n(NaNO3)=0.3L×2mol/L-$\frac{4.48L}{22.4L/mol}$=0.4mol,
根据钠离子守恒可得:n(NaOH)=n(NaNO3)=0.4mol,
故需要NaOH溶液的最小体积为:$\frac{0.4mol}{1mol/L}$=0.4L=400mL,
故选A.
点评 本题考查有关混合物的计算,题目难度中等,判断溶液中溶质为硝酸钠是关键,再利用N原子守恒计算.


科目:高中化学 来源: 题型:实验题
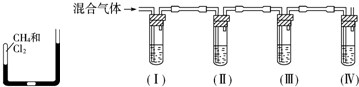
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
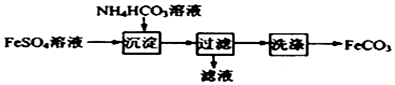
| A. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| B. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| C. | 沉淀过程中有CO2气体放出 | |
| D. | 检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
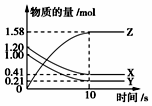 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.079mol•(L•s)-1 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol•L-1 | |
| C. | 该反应不是可逆反应 | |
| D. | 反应的化学方程式为X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 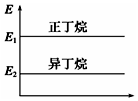 正丁烷与异丁烷的能量大小关系如图 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中混有的乙烯 | 酸性高锰酸钾溶液洗气 | 乙烯与酸性高锰酸钾溶液反应而乙烷不能 |
| D | 除去乙酸乙酯中混有的乙酸 | 用饱和碳酸钠溶液洗涤后分液 | 乙酸能与碳酸钠反应生成溶于水的盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com