


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、乙烯能使溴水和酸性KMnO4溶液褪色 |
| B、体积分数为75%的酒精溶液会使细菌蛋白质变性 |
| C、1mol甲烷和1mol氯气在光照条件下充分反应,生成1mol CH3Cl |
| D、CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
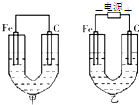 如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答:
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)与N元素同周期的第一电离能最大且电负性最小的元素的基态原子核外电子排布式为
(1)与N元素同周期的第一电离能最大且电负性最小的元素的基态原子核外电子排布式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可加入硫酸以提高电解质的导电性 |
| B、充电时LiFePO4只发生还原反应 |
| C、充电过程中,电池正极材料的质量增大 |
| D、放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 7 |
2- 4 |
2- 7 |
2- 7 |
| A、①② | B、①③ | C、①④ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com