
在标准状况下进行甲、乙、丙三组实验,各取30 mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
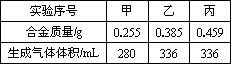
试回答:
(1)甲组实验中,盐酸________,乙组实验中,盐酸________(填“不足量”、“适量”或“过量”).
(2)要推导出盐酸的物质的量浓度,所提供的数据中作为计算依据的是________,计算出盐酸的物质的量浓度为________mol·L-1.
(3)计算合金中Mg、Al的物质的量比,所提供的数据中作计算依据的是________,计算出Mg、Al物质的量比为________.
(4)在丙组实验之后,向容器中加入一定体积1 mol·L-1的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子刚好沉淀完全,则溶液中偏铝酸钠的物质的量为________mol,氯化钠的物质的量为________mol,所加苛性钠溶液的体积为________mL.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 0.255 | 0.385 | 0.459 |
| 生成气体/ml | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
生成气体/mL | 280 | 336 | 336 |
(1)甲、乙两组实验中,哪一组盐酸是不足量的?______(填“甲”或“乙”)。理由是__________。
(2)盐酸的物质的量浓度为____________。(3)Mg、Al物质的量之比为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.255 | 0.385 | 0.459 |
生成气体的体积/mL | 280 | 336 | 336 |
请计算:
(1)盐酸的物质的量浓度。
(2)合金中镁与铝的物质的量的比值。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.255 | 0.385 | 0.459 |
生成气体的体积/mL | 280 | 336 | 336 |
请计算:
(1)盐酸的物质的量浓度。
(2)合金中镁与铝的物质的量的比值。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸___________________(填“过量”“适量”或“不足量”),理由是_________________________________________________________。
(2)要计算盐酸的物质的量浓度,题中可作为计算依据的数据是_____________________。
(3)要计算合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是__________,Mg、Al的物质的量之比是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com