
 (1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6kJ的热量,试写出对应的热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1.标准状况下11.2L氢气在氯气中充分燃烧放出的热量是92.3kJ.
(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6kJ的热量,试写出对应的热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1.标准状况下11.2L氢气在氯气中充分燃烧放出的热量是92.3kJ.分析 (1)依据热化学方程式的书写原则和注意问题写出,标注聚集状态和焓变,标准状况下11.2L氢气物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合热化学方程式计算;
(2)△H=生成物能量和-反应物能量和,从图象可见,反应物的能量低于生成物,反应吸热,据此分析.
解答 解:(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6kJ的热量,对应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1,标准状况下11.2L氢气物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,反应放热=184.6 kJ•mol-1×0.5mol=92.3KJ,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1;92.3;
(2)①反应物的能量高于生成物,1mol气体A和1mol气体B具有的能量比1mol气体C和1mol气体D具有的总能量一定高,故答案为:大于;
②△H=生成物能量和-反应物能量和<0,反应放热,△H=反应物活化能-生成物活化能=(E1-E2)kJ/mol,故答案为:放热;(E1-E2).
点评 本题通过图象分析反应放热还是吸热与反应物生成物能量高低的关系,以及通过活化能计算焓变的方法,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
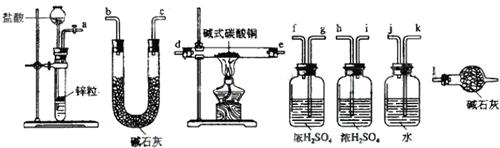
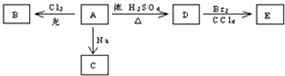 化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化: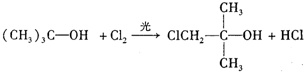 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量比为11:16 | B. | 密度比为16:11 | ||
| C. | 体积比为16:11 | D. | 体积比为11:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12553I 原子核内中子数为53 | |
| B. | 12553I原子核外电子数为72 | |
| C. | 12553I 和12753I互为同位素 | |
| D. | 12553I代表有53个质子和125个中子的碘原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若体积相等,则密度相等 | B. | 若质量相等,则质子数相等 | ||
| C. | 若分子数相等,则体积相等 | D. | 若原子数相等,则电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com