
| A. | 晶体熔点由低到高:F2<Cl2<Br2<I2 | |
| B. | 熔点由高到低:Rb>K>Na | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
分析 A.卤族元素单质都是分子晶体,分子晶体熔沸点与其相对分子质量成正比;
B.碱金属族元素单质熔沸点与金属键成正比,金属键与离子半径成反比;
C.原子晶体中,键长越短其硬度越大;
D.离子晶体晶格能与离子电荷成正比,与离子半径成反比.
解答 解:A.卤族元素单质都是分子晶体,分子晶体熔沸点与其相对分子质量成正比,单质的相对分子质量随着原子序数增大而增大,所以熔沸点随着原子序数增大而增大,即晶体熔点由低到高:F2<Cl2<Br2<I2,故A正确;
B.碱金属族元素单质熔沸点与金属键成正比,金属键与离子半径成反比,随着原子序数增大,其原子半径增大,所以金属键减弱,其单质的熔沸点随着原子序数增大而减小,熔点由高到低:Na>K>Rb,故B错误;
C.原子晶体中,键长越短其硬度越大,键长C-C<C-Si<Si-Si,所以硬度大小顺序是金刚石>碳化硅>晶体硅,故C正确;
D.离子晶体晶格能与离子电荷成正比,与离子半径成反比,从F到I其简单阴离子半径随着原子序数增大而增大,所以其晶格能随着原子序数增大而减小,则晶格能由大到小:NaF>NaCl>NaBr>NaI,故D正确;
故选B.
点评 本题考查晶体熔沸点高低判断,明确晶体类型及晶体熔沸点高低影响因素是解本题关键,熟悉常见物质的晶体类型,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
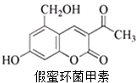 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如图.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如图.下列对假蜜环菌甲素的性质叙述正确的是( )| A. | 假蜜环菌甲素可以发生消去反应 | |
| B. | 1 mol假蜜环菌甲素可与 6 mol H2 发生加成反应 | |
| C. | 假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 | |
| D. | 假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 冰醋酸 | 福尔马林 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 油酯 | 淀粉 | 苛性钾 | 氢硫酸 | 碳酸钙 |
| D | 重水 | 纤维素 | 氯化钠 | 次氯酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 核外电子排布相同的微粒化学性质也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 碱性强弱:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了能量最低、泡利原理和洪特规则.
,这样排布遵循了能量最低、泡利原理和洪特规则.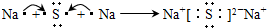 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/pm | 160 | 143 | 112 | 104 | 66 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 与稀盐酸反应的剧烈程度:L单质<Q单质 | |
| B. | 热稳定性:H2T<H2R | |
| C. | M与T形成的化合物具有两性 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液,看紫红色是否褪去 |
| C | 分离Br2和CCl4混合物 | 向混合物中加入蒸馏水,然后分液 |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com