
(碱式氧化镍 (Ni00H)可用作镍氢电池的正极材料。以含镍(Ni2+ )废液为原料生产 Ni00H的一种工艺流程如下:
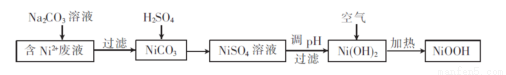
(1)加入Na2C03溶液时,证明Ni2+已经完全沉淀的实验方法是 ,过滤时需用到的玻璃仪器有烧杯、 。
(2)写出碳酸镍与稀硫酸反应的离子方程式 : 。
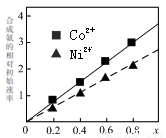
(3)硫酸镍溶液可用于制备合成氨的催化剂C0ni(1-n) Fe204。
如图表示在其他条件相同时合成氨的相对初始速率随催化剂中w值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是 。
(4)写出在空气中加热Ni(0H)2NK0H)制取Ni00H的化学方程式: 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列过程中,破坏的作用力相同的是
A.干冰升华和碘升华 B.HCl溶于水和NaCl溶于水
C.石英熔化和冰熔化 D.NH4Cl受热分解和HI受热分解
查看答案和解析>>
科目:高中化学 来源:2016届安徽马鞍山、淮北、铜陵四校高三上第三次联考化学试卷(解析版) 题型:填空题
汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等。对汽车尾气的治理使环境工作者面临了巨大的挑战。试回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是____________________;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=______(用含Ka、Kh的代数式表示),此时溶液的温度______25℃(“>”、“<”、“=”)。
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。
CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。

(4)化工上还可以利用CH3OH生成CH3OCH3。在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH | CH3OCH3 | H2O | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
该反应的正反应为________反应(填“吸热”、“放热”),若起始是向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向_____方向进行(填“正”、“逆”)。
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用。已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如右图所示:
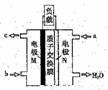
质子穿过交换膜移向_____电极区(填“M”、“N”),负极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:填空题
雾霾天气严重影响人们的生活,氮氧化物和硫氧化物是造成雾霾的主要原因之一。
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。
(1)某同学测得该样本所含水溶性无机离子的化学组分及其平均浓度列出下表:(若缺少的离子用H+或OH-补充):
离子 | K+ | Na+ | NH4+ | SO32- | NO3- | Cl- |
浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
根据表中数据判断该试样的pH=_______;该表有一处笔误,请你指正_____________________。
Ⅱ.消除氮氧化物和硫化物有多种方法。
【方法一 】:工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4(连二亚硫酸钠)和NH4NO3 产品的流程图如图1(Ce为铈元素):
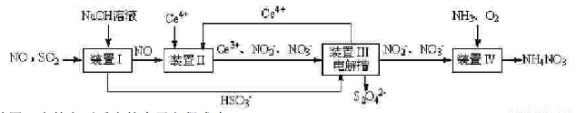
(2)装置Ⅰ中的主要反应的离子方程式为_____________________________。
(3)装置Ⅲ可以使Ce4+中再生,若用甲烷燃烧电池电解该装置中的溶液,当消耗24g甲烷时,理论上可再生______________mol Ce4+。
(4)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,
该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7.求吸收液中的SO32-的浓度_____________。(结果保留2位有效数字)
【方法二 】:NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图2所示:
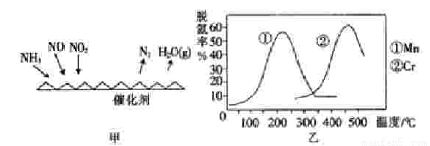
(5)图乙是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图综合考虑可知最佳的催化剂和相应的温度分别为____________。
(6)用Fe做催化剂时,在氨气足量的情况下,不同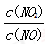 =1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
=1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
【方法三 】用活性炭还原法可以处理氮氧化物。
反应原理:1/2C(s)+NO(g) 1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
在T1℃时,反应进行到不同的时间测得各物质的浓度如下:
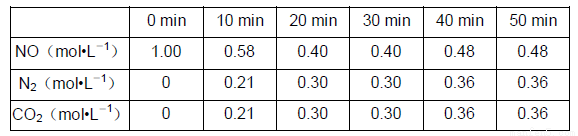
(7)T1℃时,该反应的平衡常数K=_________________________。
(8)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是______。
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第三次月考化学试卷(解析版) 题型:推断题
现有原子序数依次增大的W、T、X、Y、Z、R六种前四周期元素.TW3能使湿润的红色石蕊试纸变蓝色.X、Y位于同一主族且Y的原子序数是X的2倍.Z、R是生活中常见金属,Z、R的器皿在潮湿空气中分别生成红褐色锈和绿色锈.
请回答下列问题:
(1)TW3的电子式为 .
(2)由W、T、X、Y中的元索组成一种离子化合物M,能发生如图转化关系:
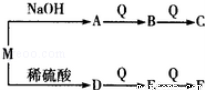
F与E的相对分子质量之差为16.则M的化学式可能为 .
C与水反应的化学方程式为 .
(3)(TW4)2Y2X8能和ZYX4在水溶液中反应生成Z2+和YX42﹣,写出离子方程式 .
(4)常温下,在WTX3浓溶液中以Z、R为电板构成原电池,负极材料是 ,
正极反应式为 .
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:填空题
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:
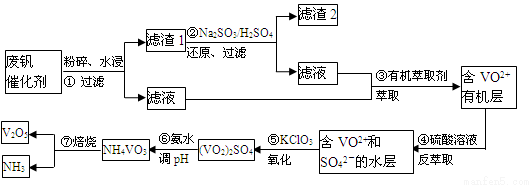
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) VO2++H2C2O4+H+ → VO2+ + CO2↑+ H2O
回答下列问题:
(1)步骤②的目的是 。
(2)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层) VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
(3)若ClO3-将被还原为Cl-,请写出骤⑤中发生反应的离子方程式为 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.00mL,由此可知(VO2)2SO4溶液钒元素的含量为 g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高一上期中化学试卷(解析版) 题型:选择题
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是:
A. H2O2 B. IO3- C. MnO4- D. HNO3
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。Z原子的最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍。X与Y、Z位于相邻的周期。下列说法正确的是
A.X的最高价氧化物对应的水化物是弱酸
B.Z位于元素周期表的第3周期第ⅥA族
C.Y的最高氧化物对应的水化物能溶于NaOH溶液
D.原子半径的大小顺序:r(Z)>r(Y)>r(X)
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省分校高三上学期12月月考理综化学试卷(解析版) 题型:选择题
工业废气中的氮氧化物是主要污染源,为了治理污染,常通入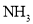 ,发生
,发生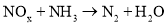 反应来治理污染.现有NO、
反应来治理污染.现有NO、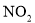 混合气体3L,用同温同压下3.5L
混合气体3L,用同温同压下3.5L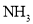 使其恰好完全转化为
使其恰好完全转化为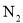 ,则混合气体中NO、
,则混合气体中NO、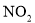 的物质的量之比为( )
的物质的量之比为( )
A.1∶1 B.2∶1 C.1∶3 D.1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com