

 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
 .
. .
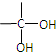
. 分析 W、A、B均能与NaHCO3溶液反应,均含有羧基,W在酸性条件下水解得到A与B,W中含有酯基,A发生消去反应、B发生水解反应均得到E,E与硝酸银反应得到淡黄色沉淀,故X为Br元素,E为NaBr,F为AgBr.A、B分子中均含有Br原子,B在氢氧化钠水溶液、加热条件下发生水解反应得到G,G酸化得到H,H分子中含有醛基且苯环上的取代基处于对位,则H为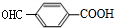 ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 .A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
.A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为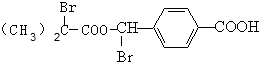 ,据此分析解答.
,据此分析解答.
解答 解:W、A、B均能与NaHCO3溶液反应,均含有羧基,W在酸性条件下水解得到A与B,W中含有酯基,A发生消去反应、B发生水解反应均得到E,E与硝酸银反应得到淡黄色沉淀,故X为Br元素,E为NaBr,F为AgBr.A、B分子中均含有Br原子,B在氢氧化钠水溶液、加热条件下发生水解反应得到G,G酸化得到H,H分子中含有醛基且苯环上的取代基处于对位,则H为 ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 .A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
.A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为 ,
,
(1)反应①属于水解反应或取代反应,②属于消去反应,A、B中均含有的含氧官能团的名称是:羧基,
故答案为:水解(或取代);消去;羧基;
(2)由以上分析可知F的化学式为AgBr,B的结构简式为 ,
,
故答案为:AgBr;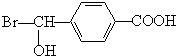 ;
;
(3)该反应方程式为:(CH3)2CBrCOOH+2NaOH$→_{△}^{醇}$CH2=C(CH3)COONa+NaBr+2H2O,故答案为:(CH3)2CBrCOOH+2NaOH$→_{△}^{醇}$CH2=C(CH3)COONa+NaBr+2H2O;
(4)若 ,由有机玻璃的分子式可知,D与甲醇发生酯化反应生成L,反应④的化学方程式是:CH2=C(CH3)COOH+CH3OH$→_{△}^{浓硫酸}$CH2=C(CH3)COOCH3+H2O,
,由有机玻璃的分子式可知,D与甲醇发生酯化反应生成L,反应④的化学方程式是:CH2=C(CH3)COOH+CH3OH$→_{△}^{浓硫酸}$CH2=C(CH3)COOCH3+H2O,
故答案为:CH2=C(CH3)COOH+CH3OH$→_{△}^{浓硫酸}$CH2=C(CH3)COOCH3+H2O;
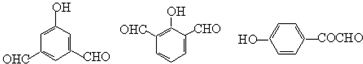
(5)H为 ,H结构简式符合下列条件:(i) 遇FeCl3显紫色说明含有酚羟基;
,H结构简式符合下列条件:(i) 遇FeCl3显紫色说明含有酚羟基;
(ii)苯环上一取代物有两种,说明苯环上有两种氢原子;
(ⅲ)除苯环外无其它环状结构,
则符合条件的同分异构体的结构简式有 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据反应条件及物质的性质判断含有的官能团,利用逆推法、正推法相结合进行推断,难点是同分异构体种类判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cu与FeCl3溶液反应:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | 铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
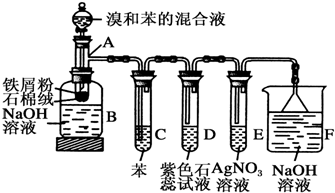
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
| 阴离子 | OH-、NO3-、I-、HCO3-、AlO2-、HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中的碳原子在一条直线上 | B. | 其一氯代物只有一种 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 结构简式为CH3 CH2 CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室利用熟石灰和氯化铵共热制取氨气:NH4++OH--$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 用食醋浸泡热水瓶中的水垢(CaCO3):CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | 向Na2SO3溶液中滴加足量NaClO溶液:SO32-+ClO-═SO42-+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com