
(10分)从某铝镁合金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是 。
后来的反应速率相当快的原因是 。
(3)写出所形成的原电池的负极材料名称:
电极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据。(请逐一写出)
(1)产生的主要现象有:切口断面处先产生气泡,反应先是较慢逐渐加快;小块合金片在溶液中上下翻动;溶液温度升高(试管外触摸发烫);反应后的溶液中残留了黑色固体。
(2)开始时产生气泡的速度较慢是因为合金表面有氧化膜。后来反应相当快的原因有:氢氧化钠溶液的浓度较大、铝镁合金片在反应时形成了许多微型原电池、反应放热溶液的温度升高等等。
(3)正极(镁):6H2O+6e=3H2+6OH-。
负极(铝):2Al+4OH—6e=2AlO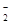 +2H2O。
+2H2O。
(4)至少有四种途径:测定残留固体(镁)的含量;测定产生氢气的体积;测定生成的偏铝酸钠的量;测定反应中有多少氢氧化钠被消耗掉
【解析】


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
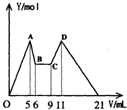 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.
某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
查看答案和解析>>
科目:高中化学 来源:浙江省杭州十四中2010-2011学年高二下学期期中考试化学试题 题型:022
从某铝镁合金片上剪下一小块(质量为1.0 g),立即投入到盛有10 mL 10 mol/L NaOH溶液的小烧杯中.
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象.(请依次写出)
(2)开始时产生气泡的速率较慢的原因是________.
后来的反应速率相当快的原因是________.
(3)写出所形成的原电池的负极材料名称:________
和电极反应式:________
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据.(请逐一写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)从某铝镁合金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是 。
后来的反应速率相当快的原因是 。
(3)写出所形成的原电池的负极材料名称:
电极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据。(请逐一写出)
查看答案和解析>>
科目:高中化学 来源:2010—2011学年浙江省杭州十四中高二下学期期中考试化学试卷 题型:填空题
(10分)从某铝镁合 金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是 。
后来的反应速率相当快的原因是 。
(3)写出所形成的原电池的负极材料名称:
电 极反应式:
极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据。(请逐一写出)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com