
分析 (1)稀释后溶液中n(NO3-)=0.2mol/L×1L=0.2mol,则被还原的n(NO3-)=0.26mol-0.2mol=0.06mol,根据Cu原子守恒得n[Cu(NO3)2]=n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,根据N原子守恒得稀释后溶液中c(HNO3)=c(NO3-)-2c[Cu(NO3)2];
(2)根据(1)知硝酸有剩余,则Cu完全反应,氧化还原反应中转移电子相等,根据Cu失去电子物质的量计算被还原硝酸得到电子物质的量;
(3)根据转移电子相等及被还原硝酸物质的量计算NO体积.
解答 解:(1)稀释后溶液中n(NO3-)=0.2mol/L×1L=0.2mol,则被还原的n(NO3-)=0.26mol-0.2mol=0.06mol,根据Cu原子守恒得n[Cu(NO3)2]=n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,根据N原子守恒得稀释后溶液中c(HNO3)=c(NO3-)-2c[Cu(NO3)2]=0.2mol/L-2×$\frac{0.05mol}{1L}$=0.1mol/L;
故答案为:0.1 mol/L;
(2)根据(1)知硝酸有剩余,则Cu完全反应,氧化还原反应中转移电子相等,所以Cu失电子物质的量等于被还原硝酸得电子的物质的量=0.05mol×2=0.1mol,故答案为:0.1 mol;
(3)根据(1)及N原子守恒知,被还原的n(NO3-)=n(HNO3)=0.06mol,转移电子物质的量为0.1mol,设生成NO的物质的量是xmol,生成NO2的物质的量是ymol,
$\left\{\begin{array}{l}{x+y=0.06}\\{3x+y=0.1}\end{array}\right.$解得$\left\{\begin{array}{l}{x=0.02}\\{y=0.04}\end{array}\right.$,
所以V(NO)=0.02mol×22.4L/mol=0.448L=448mL,
故答案为:448.
点评 本题考查氧化还原反应的有关计算,为高频考点,侧重考查学生分析计算能力,利用转移电子守恒、N原子守恒解答即可,难点是硝酸物质的量浓度计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 1:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
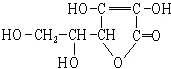
| A. | 分子式为C6H8O6 | B. | 易起氧化及加成反应 | ||
| C. | 可以溶于水 | D. | 在碱性溶液中能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②③④ | B. | .①②③ | C. | ②③④ | D. | .① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 500℃、30Mpa下,将0.5molN2和1.5molH2置于密闭容器中充分反应,放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com