
| A. | 只有②④ | B. | 只有①⑤⑥ | C. | 只有②④⑥ | D. | 只有③⑤ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②同主族元素化合物的性质具有相似性;
③ⅠA、ⅡA族元素的原子失掉最外层电子形成阳离子;
④过渡元素都是金属元素;
⑤由同主族元素的性质可知,从上到下非金属减弱;
⑥Li燃烧生成Li2O,从上到下,金属性增强.
解答 解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>H2O>H2S,故错误;
②第ⅡA元素硫酸盐性质的递变规律,硫酸钡(BaSO4)是难溶于水的白色固体,则硫酸锶(SrSO4)是难溶于水的白色固体,故正确;
③H+最外层没有电子,其它ⅠA、ⅡA族元素的阳离子比同周期稀有气体元素的原子的核外电子排布少一个电子层,所以ⅠA、ⅡA族元素的阳离子与上一周期稀有气体元素的原子具有相同的核外电子排布(氢元素除外),故错误;
④从ⅢB族到ⅡB族10个纵行的元素属于过渡元素,过渡元素都是金属元素,故正确;
⑤不能利用反应条件比较非金属性,由同主族元素的性质可知,从上到下非金属减弱,则非金属性为N>P,故错误;
⑥Li燃烧生成Li2O,从上到下,金属性增强,则LiOH为弱碱,故错误;
故选A.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,涉及氢化物越稳定、金属性和非金属性比较等,把握元素的位置、元素周期律即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
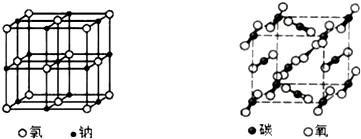
| A. | 两种晶体内均含有共价键 | B. | 构成两种晶体的微粒均是原子 | ||
| C. | 两者的硬度、熔沸点差别较大 | D. | 两种晶体均属于离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3 H2S CO2 | B. | H2O NH3•H2O H3PO4 | ||
| C. | H2SO3 BaSO4 CH4 | D. | MgSO4 CH3COOH CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
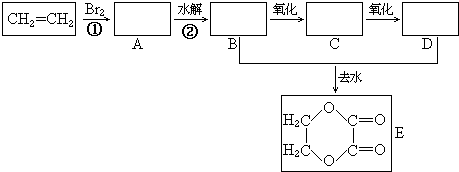
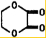 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:D>M>N>A | B. | 反应②中H2是氧化产物 | ||
| C. | 金属性:A>N>D>M | D. | 氧化性:M2+>N2+>A2+>D2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
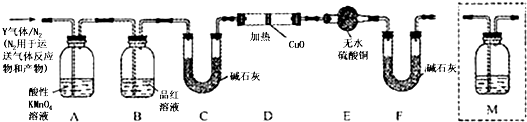
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com