
(1)2 mol O3与3 mol O2的质量之比 ,分子数之比 ,同温同压下的密度之比 ,含氧原子数之比 ,体积之比 。
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10 L O3与 L Cl2的消毒能力相当。
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为 ,推断的依据为 。
科目:高中化学 来源:2014年高考化学苏教版总复习 10-4 化学实验方案设计与评价练习卷(解析版) 题型:选择题
从下列事实所得出的相应结论正确的是( )
序号 | 实验事实 | 结论 |
① | Cl2的水溶液可以导电 | Cl2是电解质 |
② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
③ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
④ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
A.①② B.②④ C.①③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷(解析版) 题型:选择题
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法不正确的是( )
A.氧化性Cr2O72->Fe3+>SO2
B.Cr2O72-能将Na2SO3氧化成Na2SO4
C.若33.6 L SO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5 mol
D.反应中Fe2(SO4)3既是氧化剂,又是还原剂
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-3 溶液的配制及分析练习卷(解析版) 题型:选择题
V LFe2(SO4)3溶液中含有a g SO42-,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量的浓度为( )
A.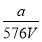 mol·L-1 B.
mol·L-1 B.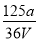 mol·L-1
mol·L-1
C.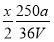 mol·L-1 D.
mol·L-1 D.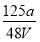 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-3 溶液的配制及分析练习卷(解析版) 题型:选择题
若20 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有2 g Ca(NO3)2,则溶液中NO的物质的量浓度为( )
A.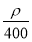 mol·L-1 B.
mol·L-1 B.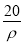 mol·L-1
mol·L-1
C.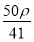 mol·L-1 D.
mol·L-1 D.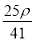 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:选择题
设阿伏加德罗常数为NA,标准状况下,mg N2和O2的混合气体含有b个分子,则ng该混合气体在相同状态下的体积为(单位为L)( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,16 g氧气和臭氧的混合物中含有NA个氧原子
B.标准状况下,11.2 L H2O中含分子数为0.5NA
C.标准状况下,22.4 L H2中含质子数为NA
D.100 mL 0.1 mol·L-1的AlCl3溶液中Al3+的个数为0.01NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-3铁、铜的获取及应用练习卷(解析版) 题型:填空题
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
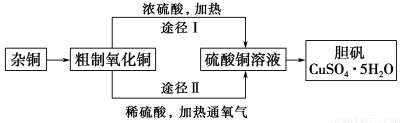
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
a蒸发皿;b石棉网;c泥三角;d表面皿;e坩埚钳;f试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是 (填字母编号)。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-3-1氧化还原反应概念和规律练习卷(解析版) 题型:选择题
已知下列反应:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O(Ⅰ);5Cl2+I2+6H2O=10HCl+2HIO3(Ⅱ)。下列说法正确的是 ( )。
A.反应Ⅰ中HCl是氧化剂
B.反应Ⅱ中Cl2发生氧化反应
C.还原性:CoCl2>HCl>I2
D.氧化性:Co2O3>Cl2>HIO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com