
某化学兴趣小组的同学为进行物质性质的探究,用维持烧瓶内压强与分液漏斗内压强相等,使液体能顺利滴下
下图所示装置进行实验。请回答下列问题:(加热及固定装置已略去)
(1)装置A中反应的化学方程式为
(2)装置C 中的试剂是 ( 填序号).
A.氢氧化钠溶液 B. 酸性高锰酸钾溶液 C.亚硫酸氢钠溶液
发生反应的离子方程式为 ,其说明了SO2具有 ,该实验操作的名称是 。
(3)在上述实验中,能说明碳的非金属性比硅强的实验现象是
(4)B中的溶液无明显现象,当滴加氯水时有白色沉淀,写出SO2表现还原性并生成白色沉淀的总离子方程式为
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2)B 2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,还原性,洗气。(3)E中的品红溶液不褪色,F中有白色沉淀。 (4)Ba2++Cl2+2H2O+SO2= BaSO4↓+4H++2 Cl-
CuSO4+SO2↑+2H2O(2)B 2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,还原性,洗气。(3)E中的品红溶液不褪色,F中有白色沉淀。 (4)Ba2++Cl2+2H2O+SO2= BaSO4↓+4H++2 Cl-
解析试题分析:(1)反应装置A中为浓硫酸与铜在加热条件下反应,故反应方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O (2)A选项,氢氧化钠与二氧化硫无现象,错误。B选项,正确,二氧化硫具有还原性,能使酸性高锰酸钾溶液褪色,可验证二氧化硫的还原性。C选项,不发生反应。无现象。错误。故选择B选项。离子反应方程式为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+。溶液褪色,证明二氧化硫具有还原性。操作名称为洗气。(3)在D反应器中,二氧化硫与碳酸氢钠溶液发生反应,产生二氧化碳,到达E反应器中,二氧化碳不能使品红褪色,但二氧化碳可以和硅酸钠溶液反应,产生硅酸沉淀,可证明碳酸的酸性强于硅酸,故碳的非金属性强于硅的非金属性。故实验现象为 E中的品红不褪色,F中有白色沉淀生成。(4)B中通入氯气,可将亚硫酸根氧化为硫酸根,产生白色沉淀。故其反应方程式为Ba2++Cl2+2H2O+SO2= BaSO4↓+4H++2 Cl-。
CuSO4+SO2↑+2H2O (2)A选项,氢氧化钠与二氧化硫无现象,错误。B选项,正确,二氧化硫具有还原性,能使酸性高锰酸钾溶液褪色,可验证二氧化硫的还原性。C选项,不发生反应。无现象。错误。故选择B选项。离子反应方程式为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+。溶液褪色,证明二氧化硫具有还原性。操作名称为洗气。(3)在D反应器中,二氧化硫与碳酸氢钠溶液发生反应,产生二氧化碳,到达E反应器中,二氧化碳不能使品红褪色,但二氧化碳可以和硅酸钠溶液反应,产生硅酸沉淀,可证明碳酸的酸性强于硅酸,故碳的非金属性强于硅的非金属性。故实验现象为 E中的品红不褪色,F中有白色沉淀生成。(4)B中通入氯气,可将亚硫酸根氧化为硫酸根,产生白色沉淀。故其反应方程式为Ba2++Cl2+2H2O+SO2= BaSO4↓+4H++2 Cl-。
考点:离子反应方程式,二氧化硫的性质实验。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列关于CO2的说法正确的是(填序号)_________。
①减少化石燃料的使用,充分利用太阳能、风能等清洁能源可有效降低大气中CO2的含量
②植树造林,增大植被面积可以有效降低大气中CO2的含量
③二氧化硫、氮氧化物、二氧化碳、悬浮微粒的含量都是空气质量日报的内容
④空气中CO2的含量过高会导致酸雨的形成
(2)下列措施不能减少二氧化碳排放的是(填序号) _________。
①利用太阳能制氢
②关停小火电企业
③举行“地球一小时”熄灯活动
④推广使用煤液化技术
(3)下列反应不产生温室气体的是(填序号)_________。
①用纯碱制玻璃 ②用煤炭作燃料
③用铁矿石炼铁 ④用氨制碳酸铵
(4)目前,关于二氧化碳是否为大气污染物有不同的观点。认为“二氧化碳不是大气污染物”的理由是(填序号)_________。
①二氧化碳是重要的化工原料
②二氧化碳是植物光合作用的必备原料
③二氧化碳是无色、无味、无毒的气体
④除二氧化碳以外,甲烷、一氧化二氮等也是温室气体
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol·L﹣1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH_______7(填“=”“>”或“<”)。
(2)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明________(填字母)
| A.该Na2S2O3溶液中水电离的c(OH﹣)=10﹣8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
| D.Na2S2O3水解方程式为S2O32﹣+2H2O=H2S2O3+2OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。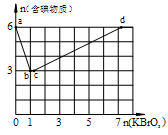
请回答下列问题:
(1)b点时,对应含碘物质的化学式为 。
(2)b→c过程中,仅有一种元素发生化合价变化, 写出该反应的化学方程式 。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为 。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为 。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是 。
(2)实验室用MnO2与浓盐酸反应制取氯气的原理如下:MnO2 + 4HCl MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
①若制取11.2 L Cl2(标准状况),则最少应加入MnO2的质量为______g。
②用平衡移动原理解释可用排饱和食盐水法收集氯气的原因 。(结合必要的化学用语及文字回答)
③制备氯气时,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a. KI溶液 b. FeCl2溶液 c. KCl溶液
写出你选择的吸收试剂与Cl2反应的离子方程式:_______。
④也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
| A.温室效应 | B.酸雨 | C.粉尘污染 | D.水体富营养化 |
 工业生产中,步骤③的反应条件为 。
工业生产中,步骤③的反应条件为 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力。下图是自然界中氮的循环图,请回答有关问题。
(1)从空气中获取氮是人类长久以来追求的目标。下列有关说法正确的是_________(填序号)。
a.图中①②③④⑤都属于自然界的固氮过程
b.在过程⑥中,氮元素的化合价降低
c.反应②的化学方程式是N2 +O2  2NO
2NO
d.德国化学家哈伯发明了合成氨工艺,其主要反应如下2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)氨经氧化后可得到硝酸,而硝酸能与氨形成含氮量很高的肥料NH4NO3,施用于土壤而实现非自然形式的氮循环。但这种肥料不适宜与碱性物质共用,否则会降低肥效,其原因是_________________________________(用离子方程式表示)。
(3)人类活动对氮循环产生着明显的影响。汽车尾气中的NO,是造成光化学烟雾的物质之一,但NO对人体又起着独特的生理作用,被誉为“明星分子”,有三位科学家因此项研究成果而获得1998年诺贝尔奖。上述事实说明我们应辨证地看待化学物质的作用。科技人员已经找到了一些解决NO排放的方法。在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分。气体在催化剂表面吸附与解吸作用的机理如下图所示。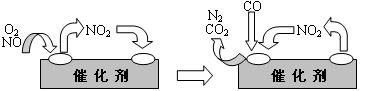
写出上述变化中的总化学反应方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
琉酸是无机“三大强酸"之一,其产量是衡量一个国家无机化工发展水平的重要标志。工业制硫酸的工艺流程如下图:
据图回答下列问题:
(1)写出用黄铁矿(主要含FeS2)造气的化学反应方程式________。
(2) 给出A、B物质的名称:A________,B________
(3) 催化氧化之前对SO2和空气的混合气体进行净化、干燥的目的是________ 选用B进入吸收塔吸收SO3的优点是________。
(4) SO2的催化氧化是一个可逆反应,采取适宜的反应条件有利于生产的进行。实际生产中,下列哪些生产条件或措施考虑到了平衡移动原理________ (选填序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.催化反应室中选择400-5000C温度
D.净化后的炉气中要有过量的空气
E. 催化氧化在常压下进行
F. 将尾气中的SO2循环利用
(5) 某硫酸厂每天消耗黄铁矿石(含FeS2质量分動60%) 20吨,生产的三阶段的转化率依次为98%、95%、98%,则该工厂一天能生产B的质量为__________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室可以用如下方法制取少量单质溴:
2NaBr+MnO2+2H2SO4 Na2SO4+MnSO4+Br2↑+2H2O
Na2SO4+MnSO4+Br2↑+2H2O
根据左图实验装置,填空和回答问题: 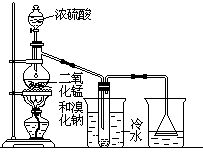
(1)装置(Ⅰ)的烧杯中冷水所起的作用是______ ,装置(Ⅱ)的烧杯中液体的作用是 ______________。
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为 ____________________________。
(3)装置(Ⅱ)烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因
________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com