
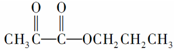 ,最简便的流程需要下列反应的顺序是
,最简便的流程需要下列反应的顺序是| A. | b d f g h | B. | e a d c h | C. | b a e c h | D. | e d c a h |
分析 由CH3CH2CH2Cl制取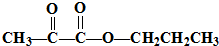 ,工艺流程为CH3CH2CH2Cl发生消去反应生成丙烯,丙烯与溴发生加成反应生成1,2-二溴丙烷,1,2-二溴丙烷在氢氧化钠水溶液、加热条件下发生水解反应生成1,2-丙二醇,氧化生成
,工艺流程为CH3CH2CH2Cl发生消去反应生成丙烯,丙烯与溴发生加成反应生成1,2-二溴丙烷,1,2-二溴丙烷在氢氧化钠水溶液、加热条件下发生水解反应生成1,2-丙二醇,氧化生成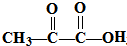 ,CH3CH2CH2Cl水解生成1-丙醇,最后
,CH3CH2CH2Cl水解生成1-丙醇,最后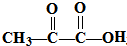 与1-丙醇发生酯化反应生成
与1-丙醇发生酯化反应生成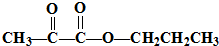 ,以此解答该题.
,以此解答该题.
解答 解:由CH3CH2CH2Cl制取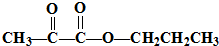 工艺流程为:CH3CH2CH2Cl发生消去反应生成丙烯,丙烯与溴发生加成反应生成1,2-二溴丙烷,1,2-二溴丙烷在氢氧化钠水溶液、加热条件下发生水解反应生成1,2-丙二醇,氧化生成
工艺流程为:CH3CH2CH2Cl发生消去反应生成丙烯,丙烯与溴发生加成反应生成1,2-二溴丙烷,1,2-二溴丙烷在氢氧化钠水溶液、加热条件下发生水解反应生成1,2-丙二醇,氧化生成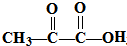 ,CH3CH2CH2Cl水解生成1-丙醇,最后
,CH3CH2CH2Cl水解生成1-丙醇,最后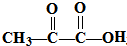 与1-丙醇发生酯化反应生成
与1-丙醇发生酯化反应生成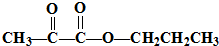 ,
,
发生反应依次为:消去反应、加成反应、取代反应、氧化反应、酯化反应,即e、d、c、a、h,
故选D.
点评 本题考查有机物的合成、有机反应类型等,为高频考点,侧重对学生基础知识的考查运用,掌握官能团的性质与转化是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | C2H6和C9H20一定互为同系物 | |
| B. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成3中二肽 | |
| C. | 葡萄糖在人体内被氧化,最终转化为二氧化碳和水,并释放能量 | |
| D. | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀析出,再加水沉淀会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO3- | |
| B. | pH=12的无色透明溶液中:Mg2+、SO42-、NO3-、K+ | |
| C. | 无色透明溶液中:SO42-、NO3-、Na+、Fe3+ | |
| D. | 澄清透明溶液中:Cu2+、SO42-、K+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
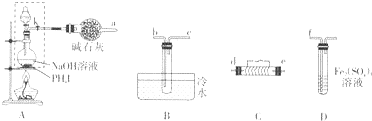
 某化学兴趣小组为了探究某些气体的性质,设计了如图所示的实验装置.实验时将A、D中产生的气体同时通入C中.(K为止水夹,部分夹持仪器已略去)
某化学兴趣小组为了探究某些气体的性质,设计了如图所示的实验装置.实验时将A、D中产生的气体同时通入C中.(K为止水夹,部分夹持仪器已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
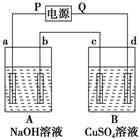 按图中装置实验,A、B两烧杯分别盛放200g 10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得电路通过电子0.5mol,试回答:
按图中装置实验,A、B两烧杯分别盛放200g 10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得电路通过电子0.5mol,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com