
| A. | MgCl2  | B. | CCl4  | C. | CO2  | D. | Na2O  |
分析 A、氯化镁为离子化合物,氯化镁中存在镁离子和氯离子,氯离子还需要标出最外层电子;
B、四氯化碳中碳原子和氯原子均满足8电子稳定结构;
C、二氧化碳是碳原子和氧原子之间通过共价双键形成的非极性分子;
D、氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷.
解答 解:A、MgCl2,氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为 ,故A错误;
,故A错误;
B、四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为 ,故B错误;
,故B错误;
C、二氧化碳是碳原子和氧原子之间通过共价双键形成的非极性分子,电子式为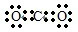 ,故C错误;
,故C错误;
D、氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为 ,
,
故D正确.
故选D.
点评 本题考查电子式的书写,题目难度不大,注意掌握电子式的书写方法:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.


科目:高中化学 来源: 题型:解答题
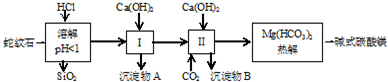
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下甲和乙的密度之比为1:1 | |
| B. | 等质量的甲和乙中的原子数之比为1:1 | |
| C. | 同温同体积下等质量的甲和乙的压强之比为1:1 | |
| D. | 甲与乙的相对分子质量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生的气体可在空气中燃烧 |
| (C)剧烈反应,产生可燃性气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞的试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业尾气SO2有多种吸收和处理方法.
工业尾气SO2有多种吸收和处理方法.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com