
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL。
 试回答下列问题:
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)该小组在步骤①中的错误是 ,
由此造成的测定结果 (偏高、偏低或无影响)。
(3)右图,是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
请计算待测烧碱溶液的浓度为 mol·L-1。
科目:高中化学 来源: 题型:
已知次氯酸是比碳酸还弱的酸,反应Cl2 + H2O 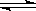 HCl + HClO达平衡后,要使HClO浓度增大,可加入( )
HCl + HClO达平衡后,要使HClO浓度增大,可加入( )
A.6mol/L NaOH溶液 B.6mol/L H2SO4溶液
C.CH3COONa固体 D.Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:
SO2(g)+ NO2(g) 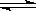 SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
试求:该温度下、该容器中,再继续加入1mol的SO2(g),则:
(1)化学平衡将向________方向移动,NO2的转化率将____________;
(2)经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是_______mol/L;
(3)整个过程中,SO2的转化率由50%变为_______%,NO2的转化率由__________%变为_______%。
(4)计算结果给我们的启示是:增大一种反应物物的用量,其转化率将________________(填“增大” 、“不变”或“减小”)另一反应物的转化率将____________(填“增大” 、“不变”或“减小”)。现实生产中的意义是:可以通过增大________的用量,来提高成本高的反应物的利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
取c(H+)均为0.01 mol/L的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
① 醋酸与锌反应放出氢气多 ② 盐酸和醋酸分别与锌反应放出的氢气一样多
③ 盐酸与锌反应放出氢气多 ④ 盐酸和醋酸分别与锌反应的速度一样大
⑤ 醋酸与锌反应速率大 ⑥ 盐酸与锌反应速率大
A.①⑥ B.②⑤ C.③④ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列做法会对人体健康造成较大危害的是 ( )
A.用小苏打(NaHCO3)发酵面团制作馒头
B.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
C.用SO2漂白银耳、腐竹等食品
D.自来水中通入少量Cl2进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法正确的是
A.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
B.甲烷、乙烯和苯都能与酸性高锰酸钾溶液反应
C.乙酸乙酯和油脂在一定条件下都能水解
D.所有烷烃中都存在碳碳单键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在碱存在下,卤代烃与醇反应生成醚(R—O—R’):
R-X+R’OH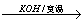 R-O-R’+HX
R-O-R’+HX
则BrCH2CH2CH2OH可发生的反应有:①氧化反应;②还原反应;③加成反应;
④在强酸强碱条件下均可发生消去反应;⑤可发生聚合反应生成高分子化合物,
其中正确的组合是
A.①②③ B.①④ C.①④⑤ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com