
已知25℃时,AgCl的溶度积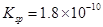 ,则下列说法正确的是:
,则下列说法正确的是:
A. 向饱和AgCl水溶液中加入盐酸,Ksp值变大
B. AgNO3溶液与NaCl溶液混合后的溶液中,一定有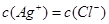
C. 温度一定时,当溶液中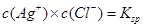 时,此溶液中必有AgCl的沉淀析出
时,此溶液中必有AgCl的沉淀析出
D. 将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI
D
【解析】
试题分析:向饱和AgCl水溶液中加入盐酸,氯离子浓度增大,沉淀溶解平衡左移形成沉淀,但温度一定.溶度积常数不变,所以Ksp值不变,故A错误;AgNO3溶液与NaCl溶液混合后的溶液中不一定有c(Ag+)=c(Cl-),混合溶液中阴银子浓度和氯离子浓度大小,取决于硝酸银和氯化钠的相对量大小,故B错误;温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,说明溶液中存在沉淀溶解平衡状态,所以此溶液为AgCl的饱和溶液,故C不正确;将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度大于AgI,沉淀向更难溶的方向进行,故D增强,答案选D。
考点:考查沉淀溶解平衡的有关判断和应用
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点。试题在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养和解题方法的指导与训练。答题时注意溶度积常数是温度的函数,沉淀转化的特点等。


科目:高中化学 来源:2014届湖北荆门高二上学期期末教学质量检测化学试卷(解析版) 题型:填空题
(1)向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到白色沉淀转变为红褐色沉淀。简述产生该现象的原因: 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字): c(OH-)-c(HA)= mol/L。
(4)已知25℃时,AgCl的溶解度为1.435×10-4g,则该温度下AgCl的溶度积常数
Ksp= mol2/L2。
电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
|
化学式 |
电离常数(25℃) |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
(5)25℃时,有等物质的量浓度的A. Na2CO3溶液、B. NaCN溶液、C.CH3COONa溶液,三溶液的pH由大到小的顺序为 。(用字母表示)
(6)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013届陕西省西安市高二12月月考化学试卷(解析版) 题型:选择题
已知25 ℃ 时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
B.AgNO3溶液与NaCl溶液混合后的溶液中,;一定有c(Ag+)=c(Cl-)
C.向饱和AgCl水溶液中加入盐酸,Ksp值变大
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI
查看答案和解析>>
科目:高中化学 来源:2011-2012年高二上学期单元测试化学试卷(新人教选修四第三章) 题型:选择题
已知25 ℃ 时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是 ( )
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出.
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com