
 2 HCl+O2��) ��Cl2+H2O
2 HCl+O2��) ��Cl2+H2O  H++Cl-+HClO���á�=�����۷֣�
H++Cl-+HClO���á�=�����۷֣� 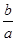 NA��
NA�� H++Cl-+HClO��3��n=m�MM,n=N�MNA,��ͬ����ʱ���������ʵĵ�Ħ������ԽС�������ʵ�����Խ��������Խ�ࡣ������������������Ħ��������С�����ķ�����Ҳ����ࡣ��������n=m�MM,��������ӵ����ʵ�����������,n=N�MNA���������������ÿ�������к���7��ԭ�ӣ�������������7���͵õ���Ӧ��ԭ��������1��Xԭ�ӵ�����Ϊb�Mag����NA��ԭ�ӵ�������ΪNAb�Mag����Ħ������ΪNAb�Mag�Mmol��X�����ԭ����������ֵ�ϵ�����Ħ��������ΪNAb �Ma��
H++Cl-+HClO��3��n=m�MM,n=N�MNA,��ͬ����ʱ���������ʵĵ�Ħ������ԽС�������ʵ�����Խ��������Խ�ࡣ������������������Ħ��������С�����ķ�����Ҳ����ࡣ��������n=m�MM,��������ӵ����ʵ�����������,n=N�MNA���������������ÿ�������к���7��ԭ�ӣ�������������7���͵õ���Ӧ��ԭ��������1��Xԭ�ӵ�����Ϊb�Mag����NA��ԭ�ӵ�������ΪNAb�Mag����Ħ������ΪNAb�Mag�Mmol��X�����ԭ����������ֵ�ϵ�����Ħ��������ΪNAb �Ma��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
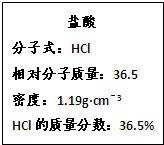
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.5 mol | B��0.6 mol | C��0.7 mol | D��0.8 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
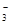 ��SO42-��Fe3+��H+��M�������ʵ���֮��Ϊ��n��NO
��SO42-��Fe3+��H+��M�������ʵ���֮��Ϊ��n��NO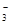 ���Un��SO42�����Un��Fe3+���Un��H
���Un��SO42�����Un��Fe3+���Un��H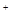 ���Un��M����2�U3�U1�U3�U1����M�����������е�
���Un��M����2�U3�U1�U3�U1����M�����������е�| A��Fe2+ | B��Cu2+ | C��Al3+ | D��Ba2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.2 mol | B��0.4 mol | C��0.6 mol | D��0.8 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������£�23g NO2����NA����ԭ�� |
| B��1 L 0.1mol?L-1�İ�ˮ����0.1NA��OH�D |
| C����״���£�22.4 L CCl4����NA ��CCl4���� |
| D��1molFe2+��������H2O2��Һ��Ӧ��ת��2NA������ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com