
一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到平衡,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
(1)反应未达到平衡,Q=1/9<k=1,平衡向正反应方向进行(2)50%(3)75%
解析试题分析:(1)当CO转化率为25%时,生成CO2和H2浓度均为0.5mol/L,未反应的CO和H2O浓度均为1.5mol/L,Q= 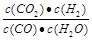 =1/9<K=1,所以反应未达到平衡状态,反应向右进行。
=1/9<K=1,所以反应未达到平衡状态,反应向右进行。
(2)设平衡时CO转化率为x。
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol/L) 2 2
平衡(mol/L)2-2x 2-2x 2x 2x
K= 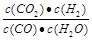 =
=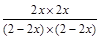 =1,x=0.5。
=1,x=0.5。
(3)设平衡时CO转化率为y。
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol/L) 2 6
平衡(mol/L)2-2y 6-2y 2y 2y
温度不变,K不变。
K=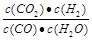 =
=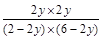 =1,y=0.75。
=1,y=0.75。
考点:化学平衡计算
点评:温度不变,平衡常数不变。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 H2CO3+OH-
H2CO3+OH- H2CO3+OH-
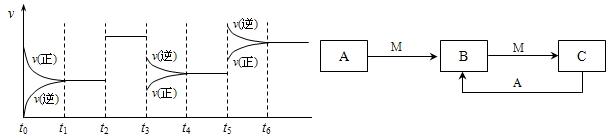
H2CO3+OH- 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. 查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的质量不再发生变化 | B、混合气体的总物质的量不再发生变化 | C、C的分子数目不再发生变化 | D、D的物质的量浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化 |
| t/s | 0 | 500 | 1 000 |
| [H2]/mol?L-1 | 5.00 | 3.52 | 2.48 |
| [CO]/mol?L-1 | 2.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com