
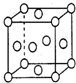
 已知铜的晶胞结构如图所示,则在铜的晶胞中所含铜原子数及配位数分别为( )
已知铜的晶胞结构如图所示,则在铜的晶胞中所含铜原子数及配位数分别为( )| A、14、6 | B、14、8 | C、4、8 | D、4、12 |
科目:高中化学 来源: 题型:

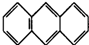 ,平面结构)属于
,平面结构)属于查看答案和解析>>
科目:高中化学 来源: 题型:
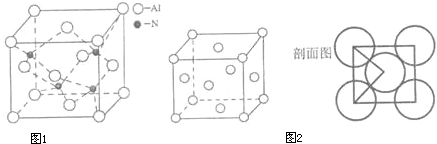
查看答案和解析>>
科目:高中化学 来源: 题型:
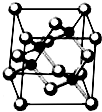 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.已知砷化镓的晶胞结构如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com