
| A. | 1 molNaN3所含阴离子总数为3NA | |
| B. | 常温常压下,28 g乙烯气体中σ键与π键数目之和为6NA | |
| C. | 标准状况下,22.4L C12通入到足量FeBr2溶液中,被氧化的Br-数目为2NA | |
| D. | 500 mL 18 mol/L的H2SO4溶液与足量Cu共热,电子转移数目为9NA |
分析 A.NaN3中阴离子为N3-,1mol中含有1mol阴离子;
B.乙烯分子中含有4个C-Hσ键,1个C-Cσ键,1个C-Cπ键;
C.二价铁离子还原性强于溴离子,氯气氧化二价铁离子再氧化溴离子;
D.浓硫酸与铜反应,随着反应的进行,浓硫酸变稀,稀硫酸与铜不反应.
解答 解:A.NaN3中阴离子为N3-,1mol中含有1mol阴离子,故A错误;
B.28 g乙烯物质的量为1mol,含有4molC-Hσ键,1molC-Cσ键,1molC-Cπ键,σ键与π键数目之和为6NA,故B正确;
C.标准状况下,22.4L C12物质的量为1mol,通入入到足量FeBr2溶液中,0.5mol氧化二价铁离子生成三价铁离子,剩余0.5mol氯气氧化溴离子,依据方程式Cl2+2Br-=2Cl-+Br2,被氧化的Br-数目为,NA,故C错误;
D.500 mL 18 mol/L的H2SO4溶液与足量Cu共热,硫酸完全反应则电子转移数目为9NA,但是随着反应的进行,浓硫酸变稀,稀硫酸与铜不反应所有转移电子数小于9NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意铜与硫酸反应的条件,题目难度中等.


科目:高中化学 来源: 题型:解答题
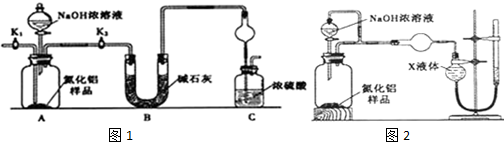
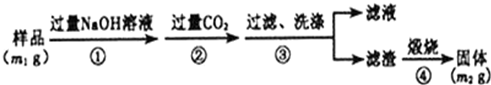
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
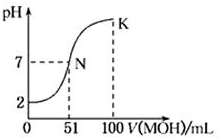 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | 滴入MOH溶液的体积为50 mL时,c(M+)>c(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,c(MOH)+c(M+)=0.02 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
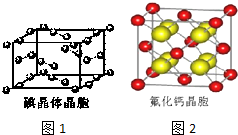 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
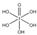 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
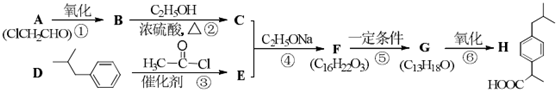
 (R1、R2代表烷基)
(R1、R2代表烷基)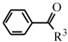 +ClCH2COOR4+R4ONa→
+ClCH2COOR4+R4ONa→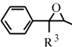 COOR4+R4OH+NaCl(R3、R4代表烷基)
COOR4+R4OH+NaCl(R3、R4代表烷基)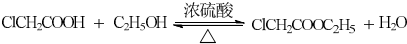 .
. .
.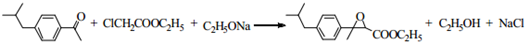 .
.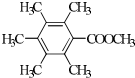 、
、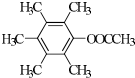 、
、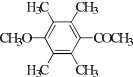 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
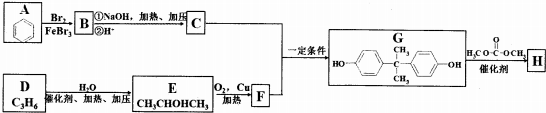
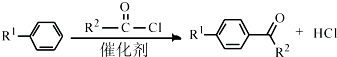
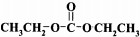 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$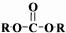 +2CH3CHOH(R为烃基)
+2CH3CHOH(R为烃基) .
. .
.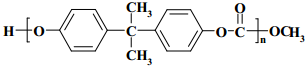 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
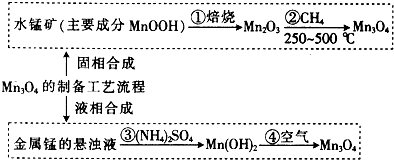
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常用的食品包装薄膜的主要成分是聚乙烯或聚氯乙烯塑料 | |
| B. | 食盐可作调味剂、食品防腐剂,还可用于调节体液电解质平衡 | |
| C. | 可利用米汤检验含碘盐的真假 | |
| D. | 利用厨房中的物品可以区别纯净的花生油与菜籽油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com