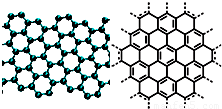
解答:解:(1)A、石墨烯是平面结构,金刚石空间网状结构,故A错误;
B.碳碳双键上所有原子都处于同一平面,所以导致石墨烯分子中所有原子可以处于同一平面,故B正确;
C.石墨烯中一个碳原子具有1.5个σ键,所以12g石墨烯含σ键数为1.5N
A,故C错误;
D.石墨结构中,石墨层与层之间存在分子间作用力,所以从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力,故D正确;
故选BD;
(2)①钴是27号元素,钴原子核外有27个电子,根据构造原理书写基态原子的核外电子排布式,注意向排4s电子再排3d电子,所以基态钴原子的核外电子排布式为[Ar]3d
74s
2,
故答案为:[Ar]3d
74s
2;
②分子晶体中,物质的熔沸点随着相对分子质量的增大而增大,但乙醇分子间能形成氢键导致乙醇的熔沸点大于氯乙烷的熔沸点,
故答案为:乙醇分子间可形成氢键,而氯乙烷分子间无氢键;
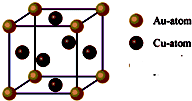
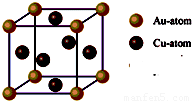
③每个晶胞中含有的铜原子数=6×
=3,含有的金原子数=
×8=1,所以它的化学式可表示为:Cu
3Au或AuCu
3,故答案为:Cu
3Au或AuCu
3;
④a.甲烷是正四面体结构,属于对称结构,所以是非极性分子;
b.乙炔是直线型结构,属于对称结构,所以是非极性分子;
c.苯是平面结构,属于对称结构,所以是非极性分子;
d.乙醇不是对称结构,所以是极性分子;
故选a、b、c;
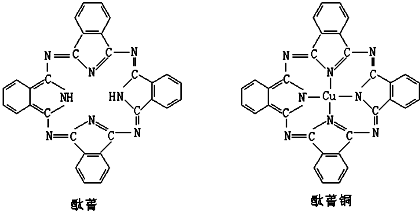
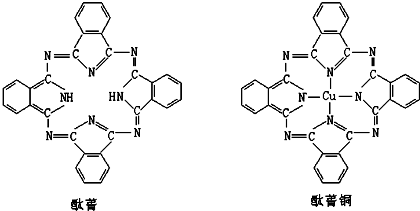
⑤酞菁分子中部分氮原子含有2个σ键一个孤对电子,所以采取sp
2杂化,部分氮原子含有3个σ键一个孤对电子,所以采取sp
3杂化;
该分子中能提供孤对电子的氮原子才是配原子,所以酞菁铜分子中心原子的配位数为:2;
故答案为:sp
3和sp
2;2;
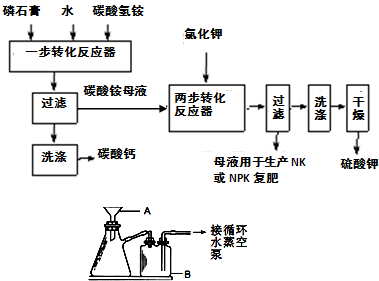
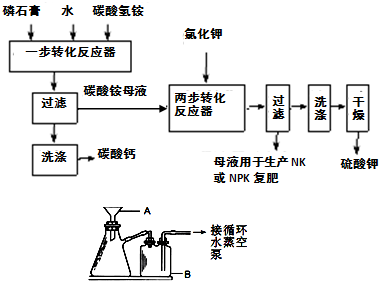
B.(1)A、B两仪器名称分别为:布氏漏斗和安全瓶,故答案为:布氏漏斗;安全瓶;
(2)碳酸氢铵易分解,为防止碳酸氢铵分解,所以反应温度必须低于35℃,故答案为:防止NH
4HCO
3分解;
(3)氯化钾和硫酸铵反应生成硫酸钾和氯化铵,反应方程式为:(NH
4)
2SO
4+2KCl=K
2SO
4+2NH
4Cl,
故答案为:(NH
4)
2SO
4+2KCl=K
2SO
4+2NH
4Cl;
(4)硫酸钾易溶于水而不易溶于乙二醇,所以加入乙二醇是为了降低K
2SO
4溶解度,有利于K
2SO
4析出,提高产率,
故答案为:降低K
2SO
4溶解度,有利于K
2SO
4析出,提高产率;
(5)铁离子和铁氰化钾反应生成KFe[Fe(CN)
6]沉淀,其反应方程式为:Fe
3++K
++[Fe(CN)
6]
4-=KFe[Fe(CN)
6]↓,故答案为:Fe
3++K
++[Fe(CN)
6]
4-=KFe[Fe(CN)
6]↓;
(6)该法优点除K
2SO
4产率高外,还有原料得到充分利用,同时得到副产品化肥等,故答案为:原料得到充分利用,同时得到副产品化肥等.

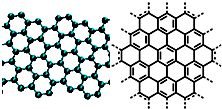
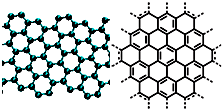 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右: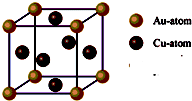


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案