
(10分)A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是 。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是 键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有 、 (分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是 。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为 (用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为 。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为 ,该物质的晶体属于 。
(第三问2分,其余每空1分) (1)1s22s22p63s23p63d9 配位
(2)N2、CO、C22-、O22+、NO+等
(3)bc (4)C<O<N 3:2 (5) 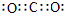 分子晶体
分子晶体
【解析】
试题分析:G的原子序数为29,则G是铜。A是宇宙中含量最多的元素,所以A是O。B原子最外层电子数是次外层电子数的2倍,则B是碳元素。F的单质是黄绿色气体,因此F是Cl。D和E原子价电子排布式均为ns2np4,所以根据原子序数大小可知,D是O,E是S。又因为C原子核外有三个未成对电子,所以C是N。
(1)根据构造原理可知,G2+的核外电子排布式是1s22s22p63s23p63d9;铜离子和氨气分子能形成配位键。
(2)价电子数和原子数分别都相等的是等电子体,因此与B、C形成的阴离子CN—互为等电子体的微粒有N2、CO、C22-、O22+、NO+等。
(3)非金属性压强,氢化物的稳定性越强。氮元素的非金属性强于碳元素的,所以氢化物稳定性是B<C,a和d都不正确;氨气分子间存在氢键,沸点高于甲烷的,b正确;非金属性压强,最高价氧化物的水化物的酸性越强,c正确,答案选bc。
(4)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子属于半充满状态,稳定性强,所以第一电离能大小顺序是C<O<N。相对分子质量为26的碳元素的氢化物是乙炔,分子中含有碳碳三键。单键都是σ键,三键是由1个σ键和2个π键构成的,所以乙炔分子中的σ键与π键数目比为3:2。
(5)七种元素中,电负性最大的元素是氧元素,和碳元素形成的化合物是CO2,含有极性键,电子式是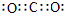
,该物质的晶体属于分子晶体。
考点:考查元素周期表的结构、核外电子的排布、等电子体、第一电离能、电负性、电子式以及晶体类型的有关判断
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。本题基础性较强,重点突出,难度不大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(10分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则C的电子式为 ,反应④的化学方程式为_______________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。请写出在水溶液中进行的反应②的离子方程式 ;
已知光照条件下D与F反应生成B,写出该反应的化学方程式: 。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高二上学期期末考试化学试卷(解析版) 题型:推断题
(10分) A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+l,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物。 回答下列问题:
(1)写出下列各元素符号:C___________ E____________
(2)A和C形成的最简单化合物的电子式为 ,A和D按原子数1:1形成的化合物的结构式为 。
(3)已知: BA3DA(g)+A2D(g)=BD2(g)+3A2(g) △H= +49.0kJ/mol
BA3DA(g)+3/2D2(g)=BD2(g)+2A2(g) △H = 一192.9kJ/mol
试写出:气态BA3DA完全燃烧生成气态A2D的热化学方程式(用推出的元素符号写,下同)
。
利用该燃烧反应设计成的燃料电池正逐步得到推广,请写出该燃料电池负极电极反应式(电解质溶液为KOH): 。
查看答案和解析>>
科目:高中化学 来源:2013届宁夏高二下学期期末考试化学试卷(解析版) 题型:填空题
(每空2分,共10分)A、B、C、D、E都是短周期元素,原子序数依次增大,五种元素核电荷总数为42,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是 ,C元素在周期表中的位置是 。
⑵C和D的离子中,半径较小的是 (填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是______________________________________________________。
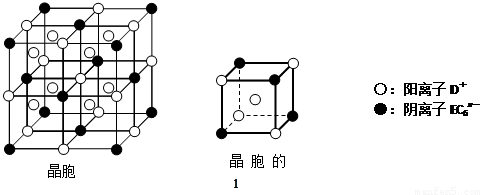
⑷C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2013届湖北省高一下学期期中考试化学试卷 题型:填空题
(10分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
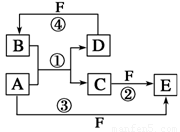
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,写出反应①的化学方程式_________________;用电子式表示C的形成过程:__________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行。如果将反应①设计成原电池,负极电极材料可选择_____(填字母代号A铁片B锌片C铜片),正极电极反应式为:_____________________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com